Основные положения квантовой химии.
1-ая идея квантовой химии: а) вещество дискретно; б) энергия квантуется.
2-ая идея квантовой химии: корпускулярно-волновой дуализм.
3-я идея квантовой химии: вероятностный характер законов микромира.
1. Дискретность - вещество состоит из отдельных микрочастиц. Именно эти частицы изучает квантовая химия. Идею квантования энергии, основываясь на спектрах излучения нагретых тел, выдвинул Планк.
2. Корпускулярно-волновой дуализм. Микрочастицы в микромире обладают и свойствами частицы, и свойствами волны.
Впервые корпускулярно-волновой дуализм был предположен для света (электромагнитного излучения). С одной стороны свет, это электромагнитная волна и для него характерны такие свойства, как интерференция и дифракция, а с другой стороны при наблюдении явления фотоэффекта, было выдвинуто предположение, что свет это поток частиц - фотонов. Была измерена даже масса фотона. Энергия фотона равна mc2.
Электрон тоже обладает двойственной природой: с одной стороны это частица, обладающая определённой массой и скоростью, с другой стороны электрон может вести себя как волна. Для потока электронов были обнаружены свойства интерференции и дифракции.
Электронография - метод изучения строения вещества, основанный на волновых свойствах потока электрона.
Уравнение, связывающее корпускулярные и волновые свойства, это уравнение де Бройля.
Е = mc2; E = hn = h 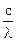 ; mc2 = h
; mc2 = h 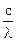 ; где l - длина волны, с - скорость света, m - масса фотона.
; где l - длина волны, с - скорость света, m - масса фотона.
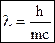 - уравнение де Бройля для световой волны.
- уравнение де Бройля для световой волны.
Для электрона уравнение де Бройля имеет вид:
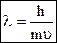 , где u - скорость электрона. Когда u ® ¥, l ® 0, l =
, где u - скорость электрона. Когда u ® ¥, l ® 0, l = 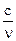 , n ® ¥.
, n ® ¥.
3. Вероятностный характер законов микромира.
В 1927 г. Гейзинберг выдвинул принцип неопределённости; согласно этому принципу невозможно точно определить местоположение частицы и её импульс в данный момент времени.
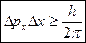 , где Dpx - погрешность импульса вдоль оси Х, Dx - погрешность координаты,
, где Dpx - погрешность импульса вдоль оси Х, Dx - погрешность координаты, 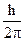 - квант действия - константа.
- квант действия - константа.
Пусть Dpx ® 0, тогда Dx ® ¥, т. к. 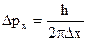 , и наоборот, если Dx ® 0,
, и наоборот, если Dx ® 0,
Dpx ® ¥.
Примечание. Эта неопределённость не связана с неточностью приборов, она является следствием самой природы электрона.
Следствия принципа неопределённости:
1. Движение электронов в атоме - это движение без траектории, поэтому понятие “орбита”, выдвинутая Бором, в настоящее время не принимается, т.е. можно говорить только с той или иной степенью вероятности о нахождении электрона на определенном расстоянии от ядра.
2. На основании принципа неопределенности можно объяснить, почему электрон не падает на ядро.
Законы движения микрочастиц в квантовой химии выражены уравнением Шредингера, который применил волновую функцию y, для описания движения электрона в 3-х мерном пространстве.
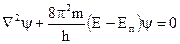 ;
;
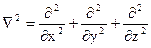 , где Ñ - оператор “набла”, y - волновая функция, Е - полная энергия, Еп - потенциальая энергия, (Е - Еп) - кинетичская энергия.
, где Ñ - оператор “набла”, y - волновая функция, Е - полная энергия, Еп - потенциальая энергия, (Е - Еп) - кинетичская энергия.
y2dV - вероятность нахождения электрона в элементарном обьёме dV.
Решение уравнения Шреденгера в полярной системе координат даёт 3 независимые величины, которые называются квантовыми числами электрона: n, l, me. Вводят также ms - спиновое квантовое число, которое характеризует движение электрона вокруг своей оси.
Квантовые числа - прастранственные и энергитические характеристики электрона. Электроны в атоме образуют электронную оболочку, которая состоит из электронных слоёв, а электронные слои состоят из атомных орбиталей.
Атомная орбиталь - область наиболее вероятного нахождения электрона.
1).n - главное квантовое число,оно характеризует размер электронного облака, т. е. расстояние от ядра до наиболее плотной части этого облака. Электроны, имеющие облака одинакового размера, независимо от формы, составляют электронный слой оболочки атома или энергитический уровень.
n принимает значения 1;2;3;…;¥. n соответствует номеру периода.
2). ℓ - орбитальное квантовое число, оно характеризует форму электронного облака или энергетический подуровень. ℓ принимает значения от 0 до n - 1.
Электроны, характеризующиеся значениями орбитального квантового числа 0,1, 2 и 3, называют соответственно s-электронами,р-электронами, d-электронами и f-электронами. При данном значении главного квантового числа n наименьшей энергией обладают s-электроны, затем р-, d- и f-электроны.
| n | ℓ | Форма облака |
| 0,1 0,1,2 0,1,2,3 | s s,p s,p,d s,p,d,f |
3). mℓ - магнитное квантовое число, оно характеризует ориентацию электрона в поле, которое создают другие электроны.
Магнитное квантовое число принимает значения 2ℓ + 1 ( - ℓ, … 0, …+ ℓ).
| ℓ | подуровень | mℓ |
| s | 1 (m = 1) | |
| p | -1, 0, +1 (m = 3) | |
| d | -2, -1, 0, +1, +2 (m = 5) | |
| f | -3, -2, -1, 0, +1, +2, +3 (m = 7) |
Электронное облако определённого размера (с определённым значением n), определённой формы (с определённым значением ℓ), и определённым образом ориентированное в пространстве (с определённым значением m), называется электронной орбиталью и изображается в виде квантовой ячейки.
s d
p f
4). ms - спиновое число.
Спиновое квантовое число отражает наличие у электрона собственного момента движения. Проекция собственного момента количества движения электрона на избранное направление и называется спином.
ms = ± ½ , т. е. электроны могут вращаться по часовой или против часовой стрелки. На одной электронной орбите могут находиться два электрона с противоположно направленными спинами.
Дата добавления: 2015-08-08; просмотров: 5136;
