Смещение равновесия.
Если не изменяются условия существования системы, то равновесие может существовать сколь угодно долго. Если изменить хотя бы одно из условий, то система выйдет из равновесия – скорости прямого и обратного процесса изменятся неодинаково – будет протекать реакция. Процесс изменения концентраций, вызванный нарушением равновесия, называется сдвигом или смещением равновесия.
Сдвиг равновесия вправо, это сдвиг в сторону продуктов реакции. Сдвиг равновесия влево, это сдвиг в сторону исходных веществ.
Принцип смещения равновесия сформулировал Ле - Шателье:
Если изменить одно из условий, при которых система находится в равновесии, то в системе усиливается та реакция, которая противодействует произведённому изменению, т. е. система сопротивляется производимым изменениям.
Используя этот принцип, всегда можно определить направление смещения равновесия.
Пример:
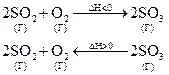
1) При увеличении температуры в системе усиливаются те процессы, в результате которых температура будет снижаться, т.е. равновесие сместится в направлении эндотермической реакции, в данном случае – в сторону обратной реакции, т.е. влево.
2) При уменьшении температуры в системе усиливаются те процессы, в результате которых температура может увеличиться, т.е. равновесие сместится в направлении экзотермической реакции, в данном случае – в сторону прямой реакции, т.е. вправо.
3) При увеличении давления равновесия смещается в сторону образования меньшего числа молекул газа, что приведет к снижению давления в данном объеме системы, т.е. в данном случае – вправо.
4) При уменьшении давления - равновесие смещается влево, т. е. в сторону образования большего количества молекул газа.
Дата добавления: 2015-08-08; просмотров: 805;
