Катализ.
Катализаторы – это вещества, которые изменяют скорость химической реакции, но не входят в состав продуктов реакции. Явление изменения скорости химической реакции под действием катализатора называют катализом.
Катализатор, как правило, ускоряет реакцию (положительный катализ). Вещества, в присутствии которых реакция замедляется (отрицательный катализ), называют ингибиторами.
Действие катализатора основано на том, что он образует с реагентами промежуточные соединения и направляет процесс по иному реакционному пути.
Основные положения теории катализа.
1) Катализ применим для изменения скорости только термодинамически возможных процессов (для каталитических реакций DG<0).
2) Катализаторы изменяют механизм реакции, направляя её по пути с меньшей энергией активации, что и приводит к увеличению скорости процесса.
Например, реакция разложения перекиси водорода ускоряется в присутствии сульфата железа (II) в 105 раз, а под действием фермента каталазы – в 1010 раз, что связано с соответствующим уменьшением энергии активации процесса:
2H2O2® 2H2O + O2 Еакт=75 кДж/моль
2H2O2 2H2O + O2 Еакт=40 кДж/моль
2H2O2 2H2O + O2 Еакт = 7 кДж/моль
3) Катализатор не влияет на тепловой эффект процесса.
4) Катализатор не влияет на положение химического равновесия, так как в равной степени ускоряет прямую и обратную реакции, сокращая тем самым время достижения равновесия.
5) Катализаторы действуют селективно, т. е. ускоряют одни процессы и не влияют на протекание других.
Так, из этанола в зависимости от катализатора и условий проведения реакции можно получить до 40 разных продуктов, например:
C2H5OH C2H4 + H2O
C2H5OH CH3CHO + H2
В отсутствие катализатора обе реакции протекают параллельно.
зависимости от фазового состояния катализатора и реагентов различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагенты находятся в одной фазе.
При гетерогенном катализе катализатор образует отдельную фазу, на поверхности которой протекает каталитическая реакция.
Механизм гомогенного катализа основан на образовании катализатором и реагентами в той же фазе реакционноспособных промежуточных соединений. В результате каталитическая реакция протекает по новому механизму, который складывается из элементарных стадий с меньшими энергиями активации, чем некаталитическая реакция, например (см. рис.1):
в отсутствие катализатора
А ® В Еакт=Е1
в присутствии катализатора К
 А В
А В
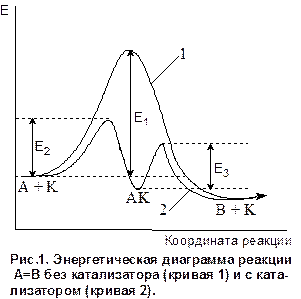 |
1 стадия А + К ® АК Еакт=Е2
2 стадия АК ® В + К Еакт=Е3.
Примером гомогенной каталитической реакции может служить разложение ацетальдегида в присутствии паров иода:
без катализатора
CH3CHO(г) ® CH4(г) + CO(г) Еакт=190 кДж/моль
в присутствии катализатора
CH3CHO(г) CH4(г) + CO(г) Еакт= 136 кДж/моль
 |
1 стадия CH3CHO + I2 ® CH3I + HI + CO
2 стадия CH3I + HI ® CH4 + I2
В качестве гомогенных катализаторов используют кислоты, основания, комплексные соединения переходных металлов. Примером гомогенного катализа является ферментативный катализ.
Механизм гетерогенного катализа более сложен и включает несколько последовательных стадий:
1) диффузия реагентов к поверхности катализатора;
2) активированная адсорбция реагентов на поверхности катализатора, в результате которой происходит сближение реакционных центров и повышение их активности под действием силового поля поверхностных атомов катализатора и, как следствие, понижение энергии активации;
3) химическое взаимодействие;
4) десорбция продуктов каталитической реакции с поверхности катализатора;
5) отвод продуктов от поверхности катализатора путем диффузии.
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора. Например, энергия активации реакции 2NH3 ® N2 + 3H2 в присутствии платинового катализатора уменьшается с 330 до 160 кДж/моль.
Катализаторами для гетерогенного катализа служат металлы (Pt, Pd, Ni, Fe, Co), оксиды металлов (Al2O3, V2O5, MnO2, Cr2O3, MoO3), сульфиды металлов (MoS2, CoS).
Дата добавления: 2015-08-08; просмотров: 1245;
