Химическое равновесие. Реакции, которые могут идти в двух взаимнопротивоположных направлениях, называются обратимыми.
Реакции, которые могут идти в двух взаимнопротивоположных направлениях, называются обратимыми.
Пример:
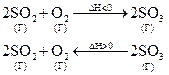
uпр = kпр 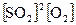 - кинетическое выражение для скорости прямой реакции,
- кинетическое выражение для скорости прямой реакции,
uобр = kобр 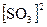 - кинетическое выражение для скорости обратной реакции.
- кинетическое выражение для скорости обратной реакции.
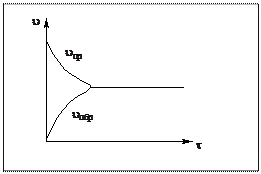
Химическое равновесие характеризуется равенством скоростей прямой и обратной реакций и постоянством концентраций всех веществ.
uпр = uобр;
Концентрации 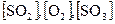 - остаются постоянными.
- остаются постоянными.
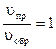 Þ
Þ 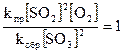 ;
; 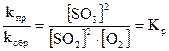 .
.
В общем виде:
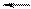
 aA + bB cC + dD
aA + bB cC + dD
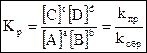 - кинетическое уравнение для константы равновесия.
- кинетическое уравнение для константы равновесия.
Констаната равновесия обратимой химической реакции равна отношению произведения концентраций продуктов реакции, взятых в некоторых степенях, к произведению концентраций исходных веществ в некоторых степнях.
Константу равновесия можно рассчитать по стандартной изотерме Вант-Гоффа:
DG° = -RT ln Kр
Дата добавления: 2015-08-08; просмотров: 693;
