Влияние температуры на скорость химической реакции.
Энергия активации (Еакт) - это избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Молекулы, обладающие избыточным запасом энергии, называются активными молекулами.
 |
Энергия активации – это фундаментальная характеристика реакции. Энергия активации зависит от природы реагентов и механизма реакции и не зависит от температуры.
Энергию активации можно представить как энергетический барьер, который необходимо преодолеть молекулам исходных веществ на пути превращения их в продукты реакции (см. рис.2). Чем больше энергия активации, тем меньше при прочих равных условиях скорость реакции и тем в большей степени она зависит от температуры. При комнатной температуре с наблюдаемой скоростью протекают реакции с Еакт от 60 до 120 кДж/моль. Реакции с Еакт>120 кДж в этих условиях практически не идут, реакции с Еакт<60 КДж/моль при обычных условиях протекают практически мгновенно.
С повышением температуры, скорость химической реакции возрастает, потому что увеличивается число активных молекул. Зависимость скорости химической реакции от температуры, при невысоких значениях температуры выражается уравнением Вант-Гоффа:
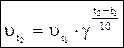
где 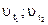 - скорости химической реакции при температурах t1 и t2.
- скорости химической реакции при температурах t1 и t2.
g - температурный коэффициент Вант-Гоффа.
Формулировка.Скорость химической реакции с увеличением температуры на каждые 10° возрастает в 2-4 раза.
Точнее зависимость скорости химической реакции от температуры выражается уравнением Аррениуса.
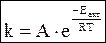
где А - фактор эффективности соударений;
е - основание натурального логарифма;
Еакт - энергия активации;
R - универсальная газовая постоянная;
Т - температура по Кельвину.
Уравнение Аррениуса – это зависимость, полученная опытным путем. Для его теоретического обоснования были предложены теория активных столкновений и теория активированного комплекса.
Согласно теории активных столкновений предэкспонециальный множитель А равен Z P , а выражение для расчета константы скорости имеет вид:
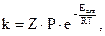
где Z – общее число столкновений молекул в единицу времени в единице объема;
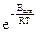 - доля активных молекул в системе;
- доля активных молекул в системе;
Р – стерический множитель.
Общее число столкновений молекул газа Z может быть рассчитано на основе молекулярно-кинетической теории газов.
Зная энергию активации, можно определить долю активных молекул при данной температуре. Так, если Еакт=100 кДж/моль , то доля активных молекул при Т=300К составит 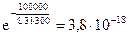 , т.е. только одно из 2,6 1017 соударений заканчивается химическим взаимодействием.
, т.е. только одно из 2,6 1017 соударений заканчивается химическим взаимодействием.
Константа скорости, вычисленная как произведение общего числа столкновения Z на долю активных молекул, как правило, превышает действительную величину. Это объясняется тем, что для химического взаимодействия молекулам кроме избыточной энергии требуется определенная взаимная ориентация в момент столкновения. Влияние пространственной ориентации молекул учитывают с помощью стерического множителя Р, значения которого лежат в пределах от 10-9 до 1. Малые значения Р отвечают реакциям между сложными по структуре органическими молекулами.
Согласно теории активированного комплекса химическая реакция протекает через образование молекулами реагирующих веществ неустойчивого переходного состояния или активированного комплекса, энергия которого (Е’) соответствует максимуму на энергетической диаграмме процесса (см рис.2). Активированный комплекс - это такое состояние реагирующей системы, при котором старые связи до конца не разорваны, а новые еще не образовались, например:
AB + C ® [ALBLC] ¹ ® A + BC
исходные активированный продукты
вещества комплекс реакции
Таким образом, энергия активации есть разность между энергией активированного комплекса Е’ и средней энергией молекул исходных веществ E1.
Теория активированного комплекса позволяет рассчитать с помощью методов статистической термодинамики энергию активированного комплекса и связать константу скорости химической реакции с его термодинамическими характеристиками – энтропией активации (DS¹) и энтальпией активации (DH¹):
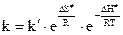 ,
,
Сравнение полученного выражения с уравнением Аррениуса показывает, что предэкспоненциальный множитель
A= 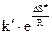 ,
,
а энергия активации
Еакт=DH¹ .
Дата добавления: 2015-08-08; просмотров: 1462;
