Химические свойства. 1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10)
1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония С6Н5NН3+, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
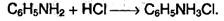
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
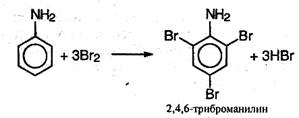
Анилин легко бромируетея даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу –NH-CO-СН3 действием уксусного ангидрида (СН3СО)О, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:
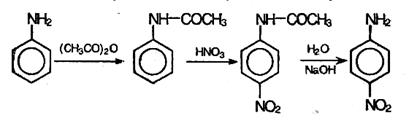
В этих реакциях образуется также небольшое количество орто-нитроанилина.
3. При реакции анилина с азотистой кислотой образуются диазо-соединения – соли диазония C6H5N2+:
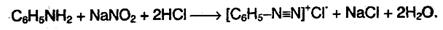
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это – качественная реакция на анилин.
Дата добавления: 2015-08-08; просмотров: 1458;
