Химические свойства. 1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов имеют щелочную реакцию:

Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
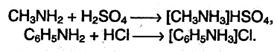
Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
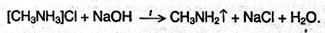
2. Амины – органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
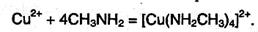
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
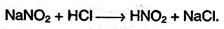
Первичные амины под действием азотистой кислоты превращаются в спирты:
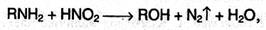
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N ≡ N]+.
Вторичные амины с азотистой кислотой дают N-нитрозамины – маслянистые жидкости с характерным запахом:
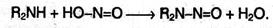
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота – реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
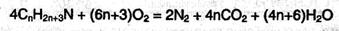
Дата добавления: 2015-08-08; просмотров: 802;
