Пептиды. Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –CO–NH–.

Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
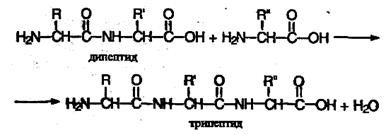
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам).
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих п остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При п = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа – справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -CH-CO-NH- и боковых групп R, R' и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений. Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить в сокращенном виде следующим образом:

Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу –CO–NH2 вместо карбоксильной.
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи, и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, – вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Белки
Белки – это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка – это конкретная последовательность аминокислот в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Вторичная структура – это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Существует два основных способа укладки цепи – α-спираль и β-структура.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NH3+ и COO- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
Третичная структура – высшая форма пространственной организации белков. Однако, некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями:
Ключевой этап определения структуры белка – расшифровка последовательности аминокислот в первичной структуре. Для этого белок сначала разделяют на полипептидные цепи (если их несколько), а затем анализируют аминокислотный состав цепей путем последовательного отщепления аминокислот. Это – чрезвычайно трудоемкая процедура, поэтому первичная структура надежно установлена только для достаточно простых белков.
Первый белок, у которого была расшифрована первичная структура, – гормон инсулин (1955г.). Это – простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая – 30 остатков), соединенных двумя дисульфидными мостиками. На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.
Пространственную структуру белков анализируют, изучая данные рассеяния рентгеновского излучения (рентгеноструктурный анализ) или нейтронов (нейтронография). Часто применяют спектроскопические методы, особенно для исследования структуры белков в водных растворах.
Принципиальная возможность синтеза белков была доказана на примере двух гормонов – вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки – инсулин и рибонуклеаза (124 аминокислотных остатка).
Для синтеза белков широко используют твердофазный метод, разработанный в начале 1960-х гг. американским химиком Б. Меррифилдом. В этом методе первая аминокислота закрепляется на полимерном носителе, и к ней последовательно подшиваются новые аминокислоты. По окончании синтеза готовая полипептидная цепь отрывается от носителя. В настоящее время искусственное получение белков осуществляется не с помощью химического, а с помощью микробиологического синтеза, путем использования микроорганизмов.
В живой природе синтез белков происходит чрезвычайно быстро, всего за несколько секунд. Живые клетки – это хорошо организованные «фабрики», в которых четко налажена система поставки сырья (аминокислот) и технология сборки. Информация о первичной структуре всех белков организма содержится в дезоксирибонуклеиновой кислоте (ДНК).
Дата добавления: 2015-08-08; просмотров: 1878;
