РЕГЕНЕРАЦИЯ
При ишемической болезни сердца, кардиомиопатиях, миокардитах наблюдаются патологические изменения кардиомиоцитов, включая их гибель, приводящие к сердечной недостаточности (нарушению насосной функции сердца). Репаративная регенерация кардиомиоцитов затруднена, т.к. они находятся в фазе G0 клеточного цикла, а аналогичные скелетно-мышечным клеткам-сателлитам G1-миобласты в миокарде отсутствуют. Однако, кардиомиоциты сохраняют способностть синтезировать ДНК, что не исключает возвращение кардиомиоцитов в клеточный цикл.Инфаркт миокарда — ишемическийнекроз участка сердечной мышцы, обычно обусловлен окклюзией коронарной артерии. Замещение погибших кардиомиоцитов соединительной тканью приводит к снижению сократительной способности миокарда и развитию сердечной недостаточности.
Сывороточные маркёры ишемии миокарда:
Сердечная изоформа тропонина I (TnI)служит надёжным маркёром ишемии миокарда, может быть обнаружена в сыворотке через 4 часа и в течение следующих 7–10 сут после появления характерной боли.
Креатинкиназа (КК).Скелетно-мышечная форма содержит две М СЕ (КК-ММ), а сердечная КК состоит из М и В СЕ (КК-МВ). При инфаркте миокарда уровень КК-МВ увеличивается в первые 4–8 ч, достигает пика через 24 ч и нормализуется на 2–3 сут после появления характерной боли.
Лактатдегидрогеназа (ЛДГ) состоит из H и M СЕ. ЛДГ-HHHH (или ЛДГ1) и ЛДГ-HHHM (или ЛДГ2) в норме экспрессируются в сердечной мышце. В крови уровень ЛДГ1 увеличивается через 2–3 сут после возникновения боли, когда уровень КК-МВ возвращается к норме. Отношение ЛДГ1/ЛДГ2 1.0 подтверждает инфаркт миокарда.
Клеточная терапия инфаркта миокарда. В эксперименте инъекция стволовых кроветворных клеток человека в хвостовую вену крысы с инфарктом миокарда стимулирует ангиогенез в ишемизированной мышце за счёт трансплантированных клеток (рис. 7-25).
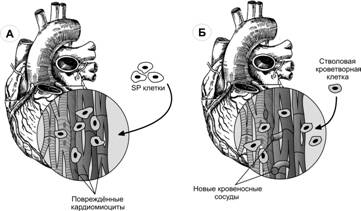
Рис. 7-25. Экспериментальные модели регенерации миокарда. А — SP клетки мыши, трансплантированные в область инфаркта миокарда, дифференцируются в кардиомиоциты. Б — стволовая кроветворная клетка человека индуцирует образование и рост кровеносных сосудов в сердечной мышце крысы при инфаркте миокарда. [143]
Сердечная недостаточность — нарушение способности сердца обеспечивать кровоснабжение органов в соответствии с их метаболическими потребностями — возникает при снижении сократительной способности, увеличении посленагрузки, или изменении преднагрузки.
Снижение сократительной способности может быть обусловлено следующими причинами:
Врождённые и приобретённые пороки сердца приводят к перегрузке полостей сердца давлением или объёмом с развитием сердечной недостаточности.
Артериальная гипертензия. Многие больные с гипертонической болезнью или симптоматическими гипертензиями страдают недостаточностью кровообращения. Снижение сократительной способностимиокарда характерно для стойкой тяжёлой гипертензии, быстро приводящей к развитию сердечной недостаточности.
Кардиомиопатии токсические (алкоголь, кобальт, катехоламины, доксорубицин), инфекционные, при так называемыхколлагеновых болезнях, рестриктивные (амилоидоз и саркоидоз, идиопатические).
Компенсаторные механизмыпри сердечной недостаточности. Феномены, вытекающие иззакона Франка-Старлинга, в том числе гипертрофия миокарда, дилатация левого желудочка, периферическая вазоконстрикция вследствие выброса катехоламинов, активация системы ренин-ангиотензин-(альдостерон) и вазопрессина, перепрограммирование синтеза миозинов в кардиомиоцитах, увеличение секреции атриопептина, — компенсаторные механизмы,поддерживающие положительный инотропный эффект. Однако, рано или поздно миокард теряет способность обеспечивать нормальный сердечный выброс.
Гипертрофия кардиомиоцитовв виде увеличения массы клеток (в том числе их полиплоидизация) — компенсаторный механизм, приспосабливающий сердце к функционированию в патологических ситуациях.
Перепрограммирование синтеза миозинов в кардиомиоцитах происходит при увеличении общего периферического сосудистого сопротивления для поддержания сердечного выброса, а также под влиянием повышенного содержания в крови Т3 и Т4 при тиреотоксикозах. Имеется несколько генов для лёгких и тяжёлых цепей сердечного миозина, различающихся по активности АТФазы, а значит, по длительности рабочего цикла и развиваемому напряжению. Перепрограммирование миозинов (как и других сократительных белков) обеспечивает сердечный выброс на приемлемом уровне до тех пор, пока не будут исчерпаны возможности этого приспособительного механизма. При исчерпании этих возможностей развивается сердечная недостаточность — левосторонняя (гипертрофия левого желудочка с последующей его дилатацией и дистрофическими изменениями), правосторонняя (застой в малом круге кровообращения).
Ренин-ангиотензин-(альдостерон),вазопрессин — мощная система вазоконстрикции.
Периферическая вазоконстрикция вследствие выброса катехоламинов.
Атриопептин — гормон, реализующий вазодилатацию.
Дата добавления: 2015-07-07; просмотров: 1278;
