Зависимость скорости реакции от температуры
Кроме концентрации и природы реагирующих веществ, важным фактором, определяющим скорость реакции, является температура.
Молекулярно-кинетическая теория газов и жидкостей дает возможность подсчитать число соударений между молекулами тех или иных веществ при определенных условиях. Если воспользоваться результатами таких подсчетов, то окажется, что число столкновений между молекулами веществ при обычных условиях столь велико, что все реакции должны протекать практически мгновенно, Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продукта реакции. Для того чтобы произошла реакция, т. е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным — не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления или разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации Ea данной реакции. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее.
По C.Аррениусу константа скорости k и энергии активации Ea связаны соотношением, получившим название уравнения Аррениуса:
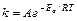 , (13.14)
, (13.14)
где A - стерический фактор, который определяет вероятность активного столкновения.
Если сталкиваются сложные молекулы, то они должны подойти друг к другу определенными концами.
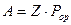 , (13.15)
, (13.15)
где Z – число столкновений в единицу времени;
Pop- вероятный фактор столкновения.
Таким образом, при постоянной температуре скорость реакции определяет энергия активации Ea. Чем больше энергия активации Ea, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении энергии активации Ea скорость возрастает, а при энергии активации Ea=0 реакция протекает мгновенно.
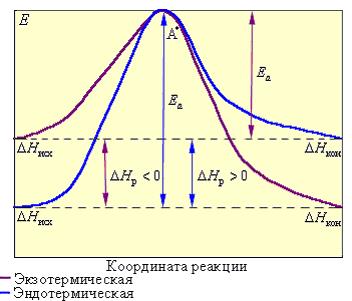
Рисунок 13.4 -Реакционный путь экзотермической и эндотермической реакции A + B → D; A* – переходное состояние, активированный комплекс
Величина Ea характеризует природу реагирующих веществ и определяется экспериментально из зависимости k=f(T). Записав уравнение (1.14) в логарифмическом виде и решая его для констант при двух температурах, находим Ea:
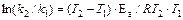 ,
,
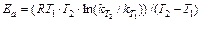 (13.16)
(13.16)
Если энергия активации Ea составляет от 50 до 100 кДж*моль-1, то из уравнения Аррениуса следует, что при изменении температуры реакции на 10 градусов ее скорость изменится в 2-4 раза. Это правило было эмпирически установлено Вант-Гоффом:
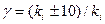 , (13.17)
, (13.17)
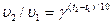 , (13.18)
, (13.18)
где g -температурный коэффициент скорости химической реакции.
Правило Вант Гоффа имеет ограниченное применение, поскольку вне области Ea=50…100 кДж *моль-1 оно вообще не выполняется.
Положительное значение энергии активации показывает, что на пути от исходных веществ к конечным продуктам имеется энергетический барьер, который не позволяет немедленно осуществляться всем термодинамически возможным реакциям.
Существуют реакции, которые замедляются при нагревании; их эффективная (полученная в результате измерения скорости процесса в целом) энергия активации отрицательна. В таких случаях стехиометрическое уравнение описывает сложный многостадийный процесс.
Для многих биологически важных реакций наблюдается ускорение процесса (отрицательная энергия активации) при замораживании водных растворов реагентов. Это объясняется возрастанием концентрации реагентов в жидких микровключениях, возникающих при медленном замораживании. В результате цикла изменения температуры замораживания пищевых продуктов от минус 5 0С до минус 18 0С («разморозка холодильника без оттайки») может быть вызвана быстрая порча.
Дата добавления: 2015-08-08; просмотров: 755;
