Зависимость скорости химической реакции от концентрации
Необходимым условием того, чтобы между частицами (молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение). Точнее говоря, частицы должны сблизиться друг; с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому 'скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентраций реагирующих веществ
Рассмотрим зависимость скорости 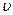 от концентрации. Предположим, имеем реакцию А+В+2D=F+L. Надо найти зависимость скорости от концентрации реагентов
от концентрации. Предположим, имеем реакцию А+В+2D=F+L. Надо найти зависимость скорости от концентрации реагентов
u = f(CA, CB, CD) = ?
Измерим скорость при каких либо концентрациях, а потом увеличим концентрацию СА вдвое и еще раз измерим скорость. Пусть она возросла вдвое. Это значит, что скорость 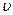 пропорциональна концентрации СА в первой степени. Увеличим концентрацию СВ вдвое. Предположим, что это не повлияло на скорость – вполне реальная ситуация. Если растворять NO2 в воде для получения азотной кислоты, то очевидно, что скорость реакции не будет зависеть от количества воды. В таком случае можно сказать, что скорость реакции
пропорциональна концентрации СА в первой степени. Увеличим концентрацию СВ вдвое. Предположим, что это не повлияло на скорость – вполне реальная ситуация. Если растворять NO2 в воде для получения азотной кислоты, то очевидно, что скорость реакции не будет зависеть от количества воды. В таком случае можно сказать, что скорость реакции 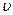 зависит от концентрации СВ в нулевой степени. Пусть теперь мы обнаружили, что от концентрации СD скорость зависит как концентрация СD 2 во второй степени. Тогда общее уравнение скорости реакции запишется как
зависит от концентрации СВ в нулевой степени. Пусть теперь мы обнаружили, что от концентрации СD скорость зависит как концентрация СD 2 во второй степени. Тогда общее уравнение скорости реакции запишется как
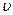 = kCACB 0 CD 2 , (13.3)
= kCACB 0 CD 2 , (13.3)
где k — коэффициент пропорциональности, называемый константой скорости данной реакции
Это уравнение называется кинетическим уравнением реакции. Величина константы скорости k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ.
Показатели степеней при концентрациях в кинетическом уравнении называются порядками реакции по данному веществу, а их сумма – общим порядком реакции. Порядки реакции устанавливаются экспериментально, а не по стехиометрическим коэффициентам. Существует совсем немного реакций, где порядок совпадает с суммой стехиометрических коэффициентов.
N2O5= 2NO2+ 1/2O2: 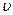 = kC(N2O5) реакция первого порядка
= kC(N2O5) реакция первого порядка
(H2)+(J2) = 2(HJ): 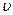 = kC(H2)C(J2) реакция второго порядка
= kC(H2)C(J2) реакция второго порядка
(Cl2) +2(NO) = 2(NOCl): 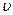 = kC(Cl2)C(NO)2 реакция третьего порядка
= kC(Cl2)C(NO)2 реакция третьего порядка
Наиболее часто встречаются реакции первого, второго, иногда ‑ третьего порядка.
H2 + Br2 = 2HBr ;
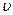 = kCH2CBr2 ½ .
= kCH2CBr2 ½ .
Иными словами, порядок может быть и дробным. Почему, рассмотрим ниже.
Реакции обычно идут по стадиям, поскольку невозможно представить себе одновременное столкновение большого числа молекул.
Предположим, что некая реакция идет по стадиям: A + 2B = C + D
1) А + В = АВ;
2) АВ + В --> C +D.
Тогда, если первая реакция идет медленно, а вторая быстро, то скорость определяется первой стадией (пока она не пройдет, не может идти вторая), т.е. накопление частиц АВ. Тогда и 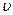 = kCACB.
= kCACB.
Скорость реакции для последовательных реакций определяется самой медленной стадией. Отсюда различие между порядком реакции и стехиометрическими коэффициентами. Например, реакция разложения перекиси водорода
2H2O2 = 2H2O+O2
на самом деле - реакция первого порядка, т.к. она лимитируется первой стадией H2O2 = H2O+O, а вторая стадия O+O = O2 идет очень быстро.
Самой медленной может быть не первая, а вторая или другая стадия, и тогда мы получаем иногда дробный порядок, выражая концентрации интермедиатов (промежуточных соединений) через концентрации начальных веществ.
Скорость реакции в момент t - мгновенная скорость - подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине ХIX столетия и получил свое название от термина «действующая масса» - синонима современного понятия «концентрация».
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г. Норвегия):
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + . . . ® . . .
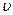 = k • [A]a • [B]b • . . . (13.4)
= k • [A]a • [B]b • . . . (13.4)
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
13.3.1Скорость реакции первого порядка:
Рассмотрим химическую реакцию первого порядка – это обычно реакции разложения или диссоциации.
H2 à 2H ;
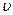 =k*C ;
=k*C ;
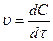 ;
;
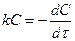 ;
; 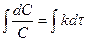 .
.
принимая для времени t=0 C = C0, получим
 , (13.5)
, (13.5)
тогда
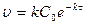 . (13.6)
. (13.6)
Концентрация реагентов и скорость реакции первого порядка уменьшаются во времени по экспоненциальному закону.
Прологарифмируем уравнение (1.4), получим
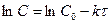 ,
,
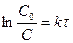 , тогда
, тогда
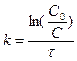 . (13.7)
. (13.7)
Константа скорости реакции первого порядка измеряется в [с-1]

Рисунок 13.2 – Изменение концентрации реагирующих веществ
для реакций первого порядка
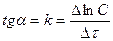
(13.8)
Период полураспада (t ½) - время, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией.
Подставим С=С0/2 в (1.6), тогда получим
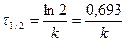 . (13.9)
. (13.9)
Период полураспада реагента в случае реакции первого порядка не зависит от начальной концентрации, а определяется константой скорости реакции.
1.3.2 Скорость реакции второго порядка
Рассмотрим реакцию второго порядка:
2HJ = H2+J2 ,
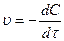 ,
, 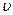 = kС2 .
= kС2 .
Используя уравнения для скоростей реакций и разделяя переменные, получим
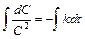 .
.
Принимая в начальный момент
C = C0 .
получим
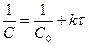 . (13.10)
. (13.10)
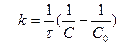 (л/моль ∙ с). (13.11)
(л/моль ∙ с). (13.11)
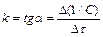 . (13.12)
. (13.12)
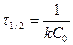 . (13.13)
. (13.13)
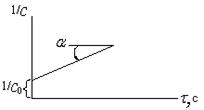 |
Рисунок 13.3 - Изменение концентраций исходных веществ во
времени для уравнений реакций второго порядка
Дата добавления: 2015-08-08; просмотров: 978;
