Скорость химической реакции. При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции)
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система физически отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной— система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2 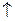 + S
+ S 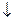 .
.
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте
Fe + 2HCl = FeCl2 + H2 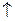
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
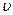 гомог =
гомог = 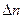 /( V
/( V 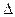 τ);
τ); 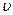 гетерог =
гетерог = 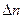 /( S
/( S 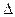 τ) . (13.1)
τ) . (13.1)
Скорость химической реакции можно определить как изменение концентрации одного из участвующих в реакции веществ (исходное вещество или продукт реакции) в единицу времени.
А®В
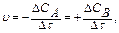
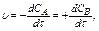 (13.2)
(13.2)
где СА, СВ – изменение концентрации исходного вещества и продукта реакции.
В любой реакции реагенты расходуются, она замедляется (см. рисунок 1).
Поэтому можно говорить только о скорости в данный момент времени. Очевидно, что скорость зависит от концентрации реагирующих веществ.

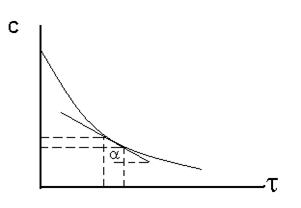
Рисунок 13.1 - Изменение концентрации исходного вещества
в ходе реакции
Если хотя бы одно из реагирующих веществ – газ, то удобно следить за скоростью по изменению объема или давлению в закрытом сосуде при постоянной температуре. Иногда можно наблюдать за изменением окраски, за появлением осадка, за изменением электропроводности и спектральных данных.
От чего зависит скорость химической реакции?
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
Дата добавления: 2015-08-08; просмотров: 755;
