Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса.
Теория электролитической диссоциации С. Аррениус содержит следующие положения:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n), к общему числу молекул, введенных в раствор (N).
a = n / N , 0<a<1 . (10.10)
Кислотой называют электролит, диссоциирующий в растворах с образованием ионов Н+; основанием называют электролит, диссоциирующий в воде с образованием гидроксид-ионов ОН 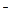 . Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в воде с образованием как ионов Н+, так и ионов ОН
. Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в воде с образованием как ионов Н+, так и ионов ОН 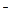 :
:
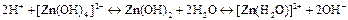 .
.
Общепринятыми считаются протонная теория электролитической диссоциации Бренстеда-Лоури и электронная теория Льюиса. Протонная теория Бренстеда-Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотойназывается вещество, способное быть донором протонов,а основанием – вещество, которое может присоединить (акцептировать) протон:
HAn =H++ An-.
По определению, HАn – кислота, An- - основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
NH3 + H+=NH4+
Любое кислотно-основное равновесие включает взаимодействие двух пар кислот и оснований.
сопряженная пара
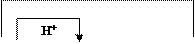 |
Кислота1 + Основание2 = Основание1 + Кислота2
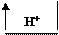 | ||||||
 |  | |||||
 |
сопряженная пара
В определённых условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому её называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары NF3(основание) и акцептора электронной пары BF3 (кислота) образуется более устойчивое электронное окружение (октет) за счёт донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
В периоде сила кислородсодержащей кислоты растёт с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
H4SiO4<H3PO4<H2SO4<HClO4.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
HClO3 > HBrO3 > HIO3.
Дата добавления: 2015-08-08; просмотров: 919;
