Высокая растворимость может быть следствием образования водородных связей (спирт-вода).
Растворимость газов в жидкостях
Растворение газа в жидкости - процесс экзотермический, с ростом температуры растворимость уменьшается (принцип Ле Шателье). Растворимость газов пропорциональна их парциальным давлениям - закон Генри.
Растворимость жидкостей в жидкостях может быть полной (спирт-вода), ограниченной (вода-анилин). Растворимость жидкости в жидкости растет с температурой и при некоторой критической температуре наблюдается полная взаимная растворимость.
Растворимость твердых веществ в жидкостях
Растворимость твердых веществ в жидкостях увеличивается с увеличением температуры, давление практически не влияет. Добавки посторонних веществ снижают растворимость данного вещества - меньше свободных молекул растворителя (эффект высаливания).
Скорость растворения твердых веществ зависит от их дисперсности – измельченный порошок растворяется быстрее первоначального продукта.
На кафедре неорганической химии С.-Петербургского университета, которую возглавлял с 1934 по 1977 г. С.А.Щукарев, проводились термохимические исследования растворов электролитов и твердых фаз. В соответствии с законом С.А.Щукарева, скорость процесса кристаллизации и обратного процесса растворения определяется скоростью подвода или отвода вещества к поверхности кристалла и описывается уравнением:
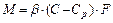 , (10.9)
, (10.9)
где b- коэффициент массоотдачи;
Cp- концентрация насыщения;
C- концентрация пересыщения;
F - поверхность кристалла.
Сольватация – взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя состоит из нескольких стадий: молекулярная диссоциация, образование сольватов, ионизация и электролитическая диссоциация:
 , стадия(a) - процесс образования сольватов
, стадия(a) - процесс образования сольватов
где АВ – молекулы растворяемого вещества;
S – молекулы растворителя.
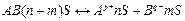 , стадия(b) - электролитическая диссоциация.
, стадия(b) - электролитическая диссоциация.
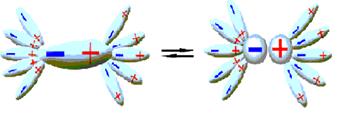
Рисунок 10.2 – Процесс образования сольватов
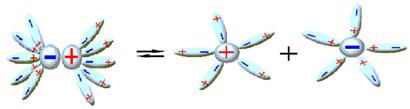
Рисунок 10.3 – Электролитическая диссоциация
Если процесс сольватации останавливается на стадии (a), то образуется раствор неэлектролита (подчиняется законам Рауля, Вант – Гоффа: раствор сахара в воде).
Если процесс протекает до стадии (b), то система является раствором электролита: растворы щелочей, солей, неорганических кислот в воде
1.3.4 Механизм электролитической диссоциации ионных веществ.
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Дата добавления: 2015-08-08; просмотров: 1394;
