Слабые электролиты
Слабые электролиты - вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе. К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH;
4) вода.
Они плохо проводят (или почти не проводят) электрический ток.
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации выражается в долях единицы или в процентах (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле-Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе.
HAn = H+ + An-.
Константа равновесия Кр этой реакции и есть константа диссоциации Кд:
Кд = [H+] . [An-]/[HAn] . (10.11)
Если выразить равновесные концентрации через концентрацию слабого электролита С и его степень диссоциации α, то получим:
Кд = С.α.С.α/С.(1-α) = С.α2/1-α. (10.12)
Это отношение называют законом разбавления Оствальда. Для очень слабых электролитов при α<<1 это уравнение упрощается:
Кд = С.α2. (10.13)
Тогда 
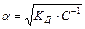 . (10.14)
. (10.14)
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Протолитическое равновесие в воде:
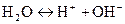 ,
,
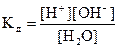 ,
,
При постоянной температуре в разбавленных растворах концентрация воды в воде [H2O] постоянна и равна 55,5  , (
, ( 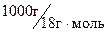 )
)
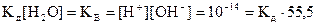 ,(10.15)
,(10.15)
где Kв – ионное произведение воды.
Тогда [H+]=10-7. На практике из-за удобства измерения и записи используют величину 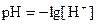 – водородный показатель, (критерий) силы кислоты или основания. По аналогии
– водородный показатель, (критерий) силы кислоты или основания. По аналогии  .
.
Из уравнения (11.15):  .При рН=7 – реакция раствора нейтральная, при рН<7 – кислая, а при pH>7 – щелочная.
.При рН=7 – реакция раствора нейтральная, при рН<7 – кислая, а при pH>7 – щелочная.
При нормальных условиях (0°С):
 , тогда
, тогда 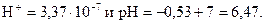
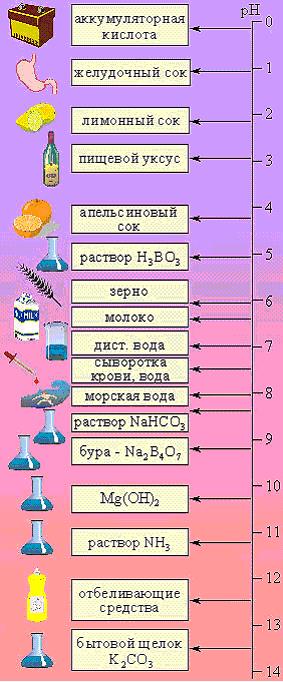
Рисунок 10.4 - pH различных веществ и систем
10.7 Растворы сильных электролитов
Сильные электролиты - это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится, в основном, в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
H2SO4 = H+ + HSO4-,
а потому константа равновесия (диссоциации) оказывается величиной неопределённой. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Голландский ученый Петрус Йозефус Вильгельмус Дебай и немецкий ученый Эрих Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
1) электролит полностью диссоциирует, но в сравнительно разбавленных растворах (СМ = 0,01 моль.л-1);
2) каждый ион окружён оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой. При электролитическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах становится неоднозначным понятие концентрации и должно заменяться активностью. Для бинарного одно-однозарядного электролита КatAn = Kat+ + An- активности катиона(а+) и аниона (а-) соответственно равны
а+ = γ+.С+, а- = γ-.С-, (10.16)
где С+ и С- - аналитические концентрации соответственно катиона и аниона;
γ+ и γ- - их коэффициенты активности.
|
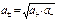 |
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значениями активностей я
и коэффициентов активностей:
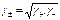 (10.18)
(10.18)
Коэффициент активности по Дебаю-Хюккелю зависит, по крайней мере, от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая-Хюккеля:
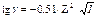 . (10.19)
. (10.19)
Ионная сила в свою очередь равна
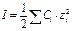 . (10.20)
. (10.20)
где С – аналитическая концентрация;
z – заряд катиона или аниона.
Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будит иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
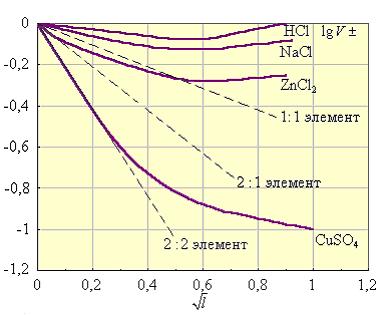
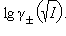
Рисунок 10.5 - Зависимость
Дата добавления: 2015-08-08; просмотров: 2695;
