Кулонометрический метод анализа основан на измерении количества электричества, затраченного на проведение электродной реакции.
В основе метода лежат законы Фарадея.
Преимущества метода:
ü более точный, чем гравиметрия
ü удобен и экспрессен
ü легко автоматизируется
Различают прямую кулонометрию и косвенную (кулонометрическое титрование).
В прямом методе определяемое вещество окисляется или восстанавливается на рабочем электроде при постоянной силе тока или при постоянном потенциале.
В косвенном методе на рабочем электроде окисляется или восстанавливается вспомогательное вещество, и продукты этих реакций вступают во взаимодействие с определяемым веществом.
Определив количество электричества, затраченного на электрохимические превращения определяемого вещества, можно рассчитать по закону Фарадея массу определяемого вещества.
Кулонометрические определения проводят в условиях, исключающих побочные процессы, то есть ВПТ=100%.
| - |
| + |
Для точного измерения количества электричества используют различные устройства, обычно это подключаемые последовательно с источником постоянного тока и кулонометрической ячейкой.
1 – ячейка, в ней идет процесс электролиза
2 – источник постоянного тока
3 – устройство для измерения количества электричества
2.
Впервые метод был предложен Хиклингом в 1942 году, в дальнейшем разрабатывался Лингейном и другими.
Кулонометрический метод при контролируемом потенциале обладает рядом преимуществ по сравнению с классической электрогравиметрией и кулонометрией при постоянной силе тока:
· вещество не обязательно выделять на электроде, достаточно чтобы протекала реакция;
· так как потенциал постоянен, то побочных процессов нет, ВПТ = 100%.
Метод применяют если:
ü в растворе есть примеси, возможно, протекание побочных реакций
ü осадок рыхлый и плохо удерживается на электроде
ü осадок вообще не выделяется
Пример: Мышьяк можно определить кулонометрически по реакции электрохимического окисления мышьяковистой кислоты H3AsO3 до мышьяковой кислоты H3AsO4 на платиновом аноде. Можно определить и другие элементы, способные существовать в более чем одной степени окисления.
ü для определения органических соеденений
| t |
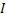
|
Для поддержания потенциала рабочего электрода на определенном уровне требуется потенциостат. Поскольку здесь происходит изменение тока во времени, для определения количества электричества строят кривую
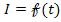
Дата добавления: 2015-08-04; просмотров: 1342;
