ЛЕКЦИЯ 23
ПЛАН:
1. Условия раздельного количественного разделения металлов. Изменение условий с целью увеличения разницы в потенциалах определяемых металлов. Воспрепятствование выделению водорода.
2. Применение ртутного электрода.
3. Условия выделения металла и качество осадка.
4. Ускоренный электролиз. Внутренний электролиз. Возможности и преимущества. Аппаратура, электроды.
1.
Последовательность выделения металлов при электролизе можно определить с помощью электродных потенциалов.
Выделение металлов считаю законченным, если его остаточная концентрация составляет 10-4 – 10-5% от исходной. Такому изменению концентрации соответствует смещение потенциала в отрицательную область на 0,2 – 0,4 В для однозарядных ионов и на 0,1 – 0,2 В для двухзарядных.
Например: При электролизе 1М раствора CuSO4 остаточная концентрация ионов меди составляет 10-4% от исходной, то есть 10-6М, тогда 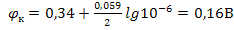 , потенциал сдвинулся в отрицательную область на 0,18В.
, потенциал сдвинулся в отрицательную область на 0,18В.
Если потенциалы выделения металлов близки, то разницу между ними можно увеличить, используя комплексообразование (чем прочнее комплекс, тем больше понижается электродный потенциал).
Иногда достаточного изменения потенциала разряда ионов можно достичь изменением температуры электролиза.
Например: При обычной температуре из водно-аммиачного раствора Zn и Ni осаждаются совместно, несмотря на значительную разницу в электродных потенциалах
( 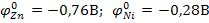 ). Это является следствием смещения потенциала разряда никеля в отрицательную область вследствие перенапряжения. При повышении температуры до 90
). Это является следствием смещения потенциала разряда никеля в отрицательную область вследствие перенапряжения. При повышении температуры до 90  перенапряжение резко снижается и раздельное выделение металлов становиться возможным.
перенапряжение резко снижается и раздельное выделение металлов становиться возможным.
При электрогравиметрическом методе анализа следует воспрепятствовать разряду на катоде ионов водорода. Совместное выделение металла и водорода приведет к затягиванию электролиза и порче осадка. Выделение металла может сместиться выделением водорода или вообще не произойти. Выделению водорода можно воспрепятствовать, если резко снизить концентрацию его ионов в растворе, то есть вести осаждение металла из щелочной среды, а для того, чтобы не образовался нерастворимый гидроксид, вводят вещества, образующие с данным катионом хорошо растворимое комплексное соединение.
Таким образом, выделение электроотрицательных металлов ведут чаще всего из комплексных соединений, электролиз электроположительных металлов можно прекратить, когда потенциал электрода станет равным потенциалу выделения водорода.
Для разделения катионов наиболее удобен метод электролиза при контролируемом потенциале катода.
При электролизе растворов потенциал выделения металлов смещается в отрицательную область вследствие уменьшения его концентрации. При этом может начаться выделение второго металла. Для того чтобы потенциал катода оставался постоянным, напряжение между электродами в электролизе уменьшают с помощью реостата. Значение потенциала катода при этом восстанавливается. В настоящее время стабилизируют катодный потенциал автоматически с помощью потенциостатов.
2.
Дата добавления: 2015-08-04; просмотров: 1322;
