Сдвиг потенциала, вызванный изменением концентрации потенциал – определяющих ионов под действием тока, называется концентрационной поляризацией.
Величина концентрационной поляризации зависит от:
Ø плотности тока (чем выше плотность, тем больше концентрационная поляризация электрода).
Снизить концентрационную поляризацию можно нагреванием и перемешиванием.
Напряжение разложения и перенапряжение:
Напряжение разложения ( 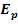 ) – это то наименьшее напряжение (наименьшая разность потенциалов), при котором может непрерывно протекать электролиз.
) – это то наименьшее напряжение (наименьшая разность потенциалов), при котором может непрерывно протекать электролиз.
Напряжение разложения не может быть меньше ЭДС поляризации ( 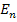 ). Оно должно быть больше ЭДС поляризации на величину перенапряжения (
). Оно должно быть больше ЭДС поляризации на величину перенапряжения ( 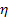 ).
).
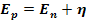
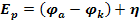
С учетом перенапряжения напряжение разложения вычисляют по формуле:
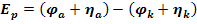
Перенапряжение – это дополнительное напряжение, которое надо приложить к электродам, для того чтобы электролиз шел беспрепятственно.
При небольшой плотности тока перенапряжение на электроде равно разности между потенциалом выделения ( 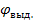 ) ионов и их равновесным потенциалом (
) ионов и их равновесным потенциалом ( 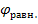 ).
).
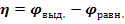
Потенциал выделения – это потенциал, необходимый для начала выделения на электроде соответствующих ионов, или потенциал электрода в тот момент, когда достигается напряжение разложения и начинается электролиз.
Потенциалы выделения металлов практически совпадают с равновесными потенциалами, то есть для многих металлов перенапряжение отсутствует, исключение составляют Fe, Co, Ni.
Потенциалы выделения газов значительно отличаются от их равновесных потенциалов. Так, для водорода потенциал выделения смещается в отрицательную область, для кислорода – в положительную область потенциалов.
При комнатной температуре и плотности тока 0,01 А/см2 перенапряжение водорода составляет:
| Металл катода | Pt | Fe | Cu | Zn | Hg | Pb |
| Перенапряжение водорода, В | - 0,07 | - 0,56 | - 0,58 | - 0,75 | - 1,04 | - 1,09 |
Перенапряжение водорода может достигать значительных величин, что позволяет выделять многие металлы, стоящие в ряду напряжения до водорода (например: Zn, Cd, Ni).
Дата добавления: 2015-08-04; просмотров: 2934;
