Лекція 1. Загальні уявлення. Місце імунології серед інших наук. 3 страница
Є чотири риси гуморальної імунної відповіді, що вражають і, на перший погляд, взаємно виключають одна одну:
1) універсальність: антитіла можуть бути виробленими проти будь-якого хімічного угрупування. Важко уявити, скільки повинно бути варіантів антитіл, якщо вважати, що кожний антиген потребує окремого антитіла;
2) специфічність: антитіла розрізняють о- чи р-положення функціональних груп, стереоізомери, білки, що відрізняються на один амінокислотний залишок;
3) гетерогенність: на один антиген виробляється багато типів (популяцій) антитіл, інколи більше 100 на одну антигенну детермінанту;
4) поліфункціональність: одне антитіло здатне зв’язувати більш ніж один антиген.
Виявляється, що саме поліфункціональність антитіл сприяє універсальності імунної відповіді, а гетерогенність – її високій специфічності.
Лекція 4. Гени імуноглобулінів. Біосинтез антитіл.
Довгий час великою проблемою імунології була неможливість пояснити походження великої різноманітності антитіл. Згідно до клонально-селекційної теорії М. Бернета, антитіла та імунні клітини різної специфічності передіснують в організмі і антиген є тільки фактором відбору, що сприяє поширенню клону клітин певної специфічності. Враховуючи догму молекулярної біології, встановлену Бідлом і Татумом у 1943 році: один ген – один поліпептидний ланцюг, кількість генів для кодування антитіл всіх можливих специфічностей перевищувала розмір геному хребетних. Після відкриття поліфункціональності антитіл їх розрахована кількість значно знизилась (до 104 – 106 варіантів), але все ж таки залишалась високою. Революційним відкриттям стало визначення того, що в генах імуноглобулінів один поліпептидний ланцюг кодується декількома генами, за рахунок комбінацій яких і досягається велика різноманітність антитіл.
У 1965 році Дрейєр і Беннет вперше запропонували, що V- і C-домени імуноглобулінів кодуються різними генами. Ці гени було ідентифіковано і з’ясовано, що вони змінюють своє положення на хромосомі в процесі розвитку організму. В 1976 році було проведено екстракцію ДНК із клітин мишачого ембріону і із клітин мієломи, що продукувала легкий ланцюг імуноглобулінів. ДНК розщепили рестрикційними ферментами, фракціонували електрофорезом в агаровому гелі і провели гібридизацію із радіоактивними пробами V- і C-генів. Було знайдено, що в клітинах ембріону V- і C гени знаходяться у різних частинах ДНК, а в ДНК зрілої мієломи вони локалізуються в одному місці. Так було доказано, що в процесі онтогенезу гени імуноглобулінів підлягають перебудові, реорганізації, в результаті якої V- і C-гени зближуються і об’єднуються.
За вивчення будови генів імуноглобулінів С.Тонегава отримав Нобелівську премію 1987 року.
Будова генів імуноглобулінів.
Існують три кластери генів імуноглобуліні: Н, k і l. Вони знаходяться на різних хромосомах. До складу кластерів входять V- і C-гени важких і легких ланцюгів, а також J-гени (від joining – поєднання) і D-гени (від diversity – різноманітність).
1. Кластер генів l-ланцюга складається із 29 V-генів і чотирьох пар J- і Сl-генів. V-гени мають лідерні послідовності. Між V- і J- генами – сотні тисяч пар основ інтрону, між J- і C-генами – невеликий інтрон.
1. Кластер генів k-ланцюга містить 40 V-генів, 5 J- генів і 1 Сk-ген.
3. Кластер генів Н-ланцюгів побудований найскладніше. Він містить більше, ніж 1000 V-генів (із них функціональних –51), 27D-генів, 6 J-генів та С-гени, що кодують важкі ланцюги всіх класів імуноглобулінів.
По мірі созрівання В лімфоцитів відбувається реорганізація цих генів:
1) сайт-специфічна рекомбінація VJ (для генів легких ланцюгів);
2) сайт-специфічна рекомбінація DJ (1) і V+DJ (2) – для генів важкого ланцюга;
3) транскрипція цілого блоку V(D)J-intron-C;
4) сплайсинг РНК з утворенням функціонального транскрипту V(D)JC;
5) трансляція;
6) посттрансляційне відщеплення лідерної послідовності.
Транскрипційний промотор активується тільки після проходження рекомбінації, тобто транскрипція неперебудованої ДНК не є можливою.
Механізм рекомбінації (на прикладі VJ).
V- і J- гени мають два типи сигналів розпізнання: гептаметр (7 пар нуклеотидів) і наномер (9 пар нуклеотидів). У V-гені між ними знаходяться 11-12 пар нуклеотидів, а в J-гені – 21-23 пари. Тому говорять, що механізм рекомбінації підкоряється правилу 12/23. Сайти кроссовера зближуються за допомогою фермента рекомбінази, яка впізнає сигнали гептамеру та наномеру на обох генах, що підлягають рекомбінації. Рекомбіназа кодується двома генами, RAG1 і RAG2. Саме початок експресії цих генів є сигналом для того, щоб у клітині почалась перебудова генів імуноглобулінів. Рекомбінція запускає транскрипцію перебудованого ланцюга, що припиняє рекомбінацію інших варіантів відповідного гену і, таким чином, визначає клональний характер лімфоцитів: кожна клітина продукує антитіла тільки однієї специфічності.
Важливо відмітити, що гіперваріабільні ділянки V-доменів (CDRs) кодуються:
- на легкому ланцюгу: 1,2 – на V-гені, 3 – на з’єднанні VJ;
- на важкому ланцюгу: 1,2 – на V-гені, 3 – на D-сегменті.
Таким чином, у будові активного центру антитіл приймають участь продукти V-, D- і J-генів.
Механізми диверсифікації імуноглобулінів.
1. Велика кількість функціональних V-генів: l - 29; k - 40; H - 51. Їх поділяють на сімейства за принципом спорідненості, що означає, що вони є продуктами дуплікації одного предкового гена.
2. Комбінаторна диверсифікація:
1) L ланцюг: VJ: 27V x 4J l = 116; 40V x 5J k = 200; 116 + 200 = 316 варіантів L-ланцюга;
2) Н ланцюг: DJ: 27 x 6 = 162; VDJ: 51 x 162 =8262; D ген має три вірогідні рамки зчитування: 8262 х 3 = 24786
3) Комбінація H x L: 316 x 24786 = 7,8 x 106
3. Мутації у сайтах рекомбінації – додають різноманітності до >108.
4. Додатковим фактором диверсифікації є TdT –термінальна дезоксинуклеотидил трансфераза – фермент, що додає нуклеотиди при перебудові V, D, J сегментів.
Таким чином, за рахунок комбінацій обмеженої кількості V, D, J генів утворюється дуже велика кількість потенційних варіантів антитіл (і відповідно, рецепторів В лімфоцитів). І це ще не все. Згадані механізми утворюють доімунний репертуар. Після зустрічі з антигеном зрілі В клітини, що знаходяться у вторинних лімфоідних органах, підлягають соматичним мутаціям. В селезінці і лімфовузлах утворюються спеціальні морфологічні структури, так звані зародкові центри, де в генах імуноглобулінів включається механізм гіпермутагенезу (як – досі невідомо) і вже перебудовані V-гени починають швидко змінюватися. Швидкість накопичення мутацій сягає 10-3 на пару нуклеотидів на генерацію клітин. Це означає, що у кожному поколінні утворюється одна мутація на 1000 пар нуклеотидів – у 106 разів частіше, ніж відбуваються мутації в інших генах. В результаті соматичних мутацій утворюється багато варіантів антитіл, які не дуже відрізняються одне від одного. Антиген, що присутній при цьому, служить фактором відбору і сприяє проліферації (розмноженню) тих клітин, рецептори яких якнайбільше до нього підходять. Відбувається тонка підгонка репертуару В клітин, які частково перетворюються на клітини пам’яті. При повторному введенні антигену, у вторинній відповіді, саме ці В клітини активуються, тому антитіла вторинної відповіді є більш специфічними, ніж первинної. Відбувається так зване созрівання імунної відповіді, підвищення її афінності, спорідненості до антигену. Явище гіпермутагенезу описане тільки для генів імуноглобулінів.
Треба зазначити, що описаний механізм диверсифікації існує не у всіх видів тварин. У овець, наприклад, різноманітність антитіл утворюється за рахунок точкових мутацій генів імуноглобулінів, які відбуваються в Пейєрових бляшках. А у птахів відбувається так звана конверсія генів: включення псевдо-V-генів, яке проходить у бурсі Фабриціуса. Таким чином, еволюційно випробувалися різні механізми досягнення різноманітності антитіл і у різних тварин було відібрано різні варіанти.
Алельне виключення.
Експериментально було показано, що кожна В клітина продукує антитіла тільки однієї специфічності. Це зрозуміло на основі того механізму перебудови генів імуноглобулінів, який ми розглянули вище. Але ж у кожного гетерозиготного організма є два набора генів, із материнського і батьківського геномів. Гени імуноглобулінів підлягають алельному виключенню, механізм якого до кінця не з’ясований. Вважають, що функціональна перебудова одного алеля є негативним сигналом для другого. На моделі трансгенних мишей було показано, що введення вже перебудованих генів імуноглобулінів в ембріони мишей пригнічує перебудову власних генів.
Попередник В клітини має два набори кластерів H-, k- і l-генів. Спочатку починає рекомбінувати один алель Н-гену, батьківський або материнський (відбір є цілком випадковим). Після декількох циклів проліферації активується один із алелей L-гена (теж випадково). DJ рекомбінація відбувається в обох хромосомах (материнській і батьківській), а VDJ – тільки в одній. Якщо перебудова пройшла успішно, продукція повноцінного m- ланцюга припиняє реорганізації в Н-генах і сигналізує початок перебудов в L-генах. Спочатку рекомбінують VJ-гени k-ланцюга; якщо такий варіант невдалий, випробуються інші варіанти VJ k ; якщо знов невдало – рекомбінують гени l ланцюга. Перша вдала комбінація дає функціональний IgM і припиняє подальшу реорганізацію (виключаються гени RAG). Наявність двох пулів генів L-ланцюга, k і l , підвищує надійність утворення повноцінної молекули імуноглобуліну. Про те, що ця вірогідність досить велика, свідчить той факт, що більшість імуноглобулінів несуть k , а не l ланцюг.
Переключення з мембранної на секретовану форму IgM.
Імуноглобуліни M, G, A і Е можуть існувати як в мембранній (рецептори В лімфоцитів), так і в розчинній формі (антитіла). Вони відрізняються природою С-кінцевого пептиду: у мембранної форми він гідрофобний і є трансмембранною частиною рецептору, а у секретованої – гідрофільний. Розглянемо механізм переключення на прикладі IgM. І мембранний, і секретований IgM кодуються одними генами. В Сm гені є фрагмент ДНК, що кодує гідрофільний пептид, і фрагмент, що кодує гідрофобний пептид. Їх транскрипція зупиняється, відповідно, двома стоп-кодонами. Спочатку, коли клітина ще не секретує імуноглобуліни, працює стоп-кодон 2. Утворюється транскрипт, що несе інформацію як про гідрофобний, так і про гідрофільний пептиди, і фрагмент, що відповідає за гідрофільний пептид вирізається як інтрон шляхом сплайсингу мРНК. Коли клітина отримує відповідні сигнали і починає секретувати імуноглобуліни, спрацьовує стоп-кодон 1 і транскрибується короткий ген без гідрофобного пептиду.
Переключення класів імуноглобулінів.
Всі В клітини починають реорганізації генів імуноглобулінів із перебудови гену m-ланцюга і продукують IgM. Переключення на IgD відбувається до зустрічі з антигеном і клітина продукує обидва класи, IgM i IgD, однієї специфічності. Після антигенної стимуляції відбувається переключення на секретовану форму IgM, а потім – на один із інших класів імуноглобулінів. Оскільки один перебудований V-ген (VDJ) може комбінувати із різними С-генами, то антитіла однієї специфічності можуть бути різних класів, мати різні Fc фрагменти і виконувати, відповідно, різні біологічні функції у різних тканинах організму.
Переключення відбувається двома різними шляхами.
1) Переключення з IgM на IgD відбувається шляхом альтернативного сплайсингу РНК транскрипту, що містить транскрипти як Сm, так і Cg генів. Саме тому клітина може одночасно експресувати і IgM, i IgD.
2) Переключення з IgM на IgG, IgE, та IgA відбувається шляхом рекомбінації і делеції (знищення) всієї зайвої ДНК і є необерненим: клітина, що почала секретувати IgG, вже не зможе продукувати IgM (мієломи, що секретують IgG чи IgA, не мають ДНК генів інших класів імуноглобулінів). Переключення на певний клас чи підклас регулюється цитокінами, які продукують різні субпопуляції Т лімфоцитів.
Біосинтез антитіл.
Після транскрипції і трансляції продукти генів важкого і легкого ланцюгів поступають в ендоплазматичний ретикулюм (ЕПР). Там відбувається збірка молекули імуноглобуліну. Згідно до закону збірки будь-яких олігомерних білків, жоден ланцюг не може вийти із ЕПР, доки він не увійшов до складу олігомеру. Ланцюги знаходяться у зв’язку з спеціальними білками-шаперонами, які утримують їх в ЕПР до повної збірки олігомеру. Так, важкий ланцюг зв’язаний із шапероном ВіР до тих пір, поки до нього не приєднається легкий ланцюг. Після цього молекула імуноглобуліну виходить із ЕПР і прямує у комплекс Гольджі, де відбувається її глікозилювання. Повноцінні антитіла накопичуються у везикулах і секретуються щляхом екзоцитозу. Рецептор В лімфоцитів, до складу якого входить мембранна форма імуноглобуліну, крім ланцюгів імуноглобуліну містить ще додаткові компоненти, необхідні для передачі сигналу від рецептору всередину клітини. При синтезі В-клітинного рецептору із ЕПР виходить весь комплекс разом.
Після антигенної стимуляції В клітина отримує сигнали диференціації і поступово перетворюється на плазматичну клітину. На відміну від лімфоциту у спокої, який має велике ядро і небагато цитоплазми, плазматичні клітини мають розвинутий ЕПР і по суті є фабриками для продукції антитіл. Вони перестають експресувати багато маркерів, характерних для В клітин, тобто стають нечутливими до багатьох зовнішніх стимулів. За даними цитоплазматичного забарвлення, їх цитоплазма заповнена антитілами. Виконавши свою функцію, плазматична клітина вже не повертається до попереднього стану і гине (час життя звичайної В клітини – 3-4 тижні). Довго живуть В клітини пам’яті, які відокремлюються в окрему гілку на ранніх стадіях диференціювання В клітин.
Гібридоми і моноклональні антитіла.
Сироваткові антитіла представляють собою гетерогенну суміш імуноглобулінів різних класів і специфічностей. Мрією імунологів з давніх часів було отримати гомогенні антитіла, щоб вивчати їхні властивості, кристалізувати для рентген-структурного аналізу та використовувати в практичних цілях. Частково цю функцію виконали мієломні антитіла, які є природними моноклональними антитілами, тобто походять із потомків однієї В клітини, яка була злоякісно трансформована. Між іншім, злоякісні новоутворення в імунній системі – це майже виключно В-клітинні захворювання. Вважають, що це є наслідком соматичного гіпермутагенезу, який із великою вірогідністю дає трансформовані клітини. Таким чином, лімфопроліферативні захворювання – це платня за високу специфічність імунної відповіді. Мієломні антитіла було успішно використано для багатьох експериментів, але мрія отримати моноклональні антитіла бажаної специфічності залишалася. Спочатку намагалися виділити їх із сироваткової суміші шляхом розділення популяцій по заряду, гідрофобності, іншим фізико-хімічним властивостям, але це було не дуже ефективно.
На початку 70-х років були вже добре розроблені методи культивування імунних клітин in vitro. Біохіміки вивчали в них, зокрема, ферменти біосинтезу пуринів та піримідинів. Було знайдено, що нормальні клітини використовують два шляхи біосинтезу пурінів: de novo і повторне використання продуктів їх розщеплення. Синтез de novo проходить за допомогою ферменту гіпоксантин-гуанін-фосфорибозил трансферази (ГФРТ). Було знайдено пухлинні лінії клітин, дефектні по цьому ферменту, тобто такі, що не могли синтезувати нуклеотиди de novo . Якщо такі клітини культивувати у присутності аміноптерину (який блокує повторний шлях використання метаболітів нуклеотидів), вони гинуть. Нормальні клітини в таких умовах виживають, так як можуть синтезувати нуклеотиди de novo. Паралельно широко вивчали методи гібридизації клітин – злиття їх мембран за допомогою електричного імпульсу або хімічної дії поліетиленгліколю. Саме на основі цих експериментів у Дж. Кьолера виникла ідея гібридизувати нормальний В лімфоцит, що продукує антитіла, із клітинами мієломи, дефектної по ГФРТ. Якщо такі клітини культивувати у присутності аміноптерину, пухлинні клітини загинуть, оскільки не можуть синтезувати пурини de novo, нормальні лімфоцити загинуть, оскільки не можуть існувати в культурі без додаткових ростових факторів, і в живих залишаться тільки гібриди, що успадкували від мієломних клітин безсмертя, а від нормальних клітин – шлях синтезу нуклеотидів de novo. Якщо тепер знайти серед них клітини, що продукують антитіла потрібної специфічності, то можна отримати їх клон і, відповідно, гомогенні моноклональні антитіла. Ц. Мільштайн, в лабораторії якого працював Кьолер, був проти таких експериментів, оскільки вважав, що вірогідність знаходження антиген-специфічних клонів у такій суміші дуже низька. Але Кьолер поставив цей експеримент на свій страх і ризик і знайшов досить багато позитивних клонів. Тепер ми знаємо, що вірогідність їх знаходження досить висока: при сильній імунній відповіді кожен 20-й із утворених клонів може бути позитивним. Експеримент Кьолера був революційним: збулася мрія поколінь імунологів, - і заслужено був нагороджений Нобелівською премією. Тепер це досить рутинна методика. Клітини, що утворюються в результаті гібридизації називають гібридомами, а процес їх отримання – гібридомною технологією. Треба зазначити, що розробка цієї технології стала можливою тільки завдяки певному рівню розвитку біохімії, методів культивування клітин in vitro і імунологічних методів, що дозволили аналізувати специфічність антитіл великої кількості утворених клонів.
Резюме.
Гени імуноглобуліни унікальні тим, що функціональний ген одного поліпептидного ланцюга складається із декількох генних фрагментів, які зближуються і об’єднуються в процесі розвитку лімфоцитів. За рахунок наявності багатьох варіантів V-генів, комбінацій VJ і VDJ, а також важких і легких ланцюгів, і деяких додаткових механізмів обмежений репертуар генів дає практично необмежений репертуар специфічностей антитіл, який іще підвищується за рахунок соматичних мутацій. Імуноглобуліни можуть існувати як в мембранній, так і в розчинній формі, що досягається за рахунок використання при транскрипції їх генів альтернативних стоп-кодонів. Переключення класів імуноглобулінів відбувається шляхом або альтернативного сплайсингу РНК, або необерненої делеції проміжної ДНК. При біосинтезі антитіл вихід із ендоплазматичного ретикулюму відбувається тільки після остаточної збірки всіх поліпептидних ланцюгів.
Лекція 5. Взаємодія антиген-антитіло та методи її вивчення.
Головною функцією антитіл (АТ) є специфічне зв’язування антигену (АГ). Це зв’язування нековалентне (утворюються електростатичні, водневі, гідрофобні, Ван-дер-Ваальсові зв’язки), обернене і може бути описаним кінетичною формулою хімічної реакції першого порядку:
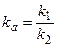 |
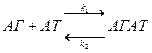 |
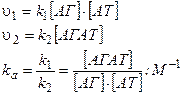 |
де k1 – константа асоціації, а k2 –константа дисоціації комплексу антиген-антитіло (АГАТ). Їх співвідношення характеризує ефективність утворення комплексу і називається константою афінності, kа. Швидкість прямої та зворотної реакції можна розрахувати. Коли реакція досягає рівноваги, υ1= υ2 і kа може бути розраховано як
Із цього рівняння видно, що kа виражається у зворотних молях і дорівнює оберненій концентрації вільного антигену, при якій у рівновазі зайнята антигеном половина зв’язуючих центрів антитіл, [AT]=[АГАТ].
Про специфічне зв’язування починають говорити, коли kа перевищує 105 М-1, тобто коли швидкість утворення комплексу перевищує швидкість його розпаду на 5 порядків. Для високоафінних антитіл kа > 108 M-1.
Константа афінності є важливою характеристикою антитіл, тому її треба вміти розраховувати. Для цього розроблено декілька математичних підходів, декілька рівнянь, найбільш вживаним є рівняння Скетчарда. Воно оперує такими поняттями як:
[B] (bound) – концентрація зв’язаного антигену;
[F] (free) – концентрація вільного антигену;
n – кількість центрів зв’язування антитіл (ціле антитіло має два центри зв’язування, а Fab фрагмент – один).
Рівняння Скетчарда:
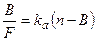 |
Уявимо, що до розчину антитіл ми поступово додаємо антиген. При цьому спочатку весь антиген зв’язується і [F] << [B]. По мірі додавання антигену [B] збільшується, але збільшується і [F], тому співвідношення [B]/[F] зменшується. Графічно це виражається як лінійна залежність B/F від В, і kа може бути розраховано як тангенс кута нахилу прямої (Рис. 3А).
Згідно із запропонованим рівнянням, графік Скетчарда – це пряма лінія. Однак при аналізі сироваткових антитіл виявилося, що графік Скетчарда, побудований за експериментальними даними, має нелінійну форму, тобто по мірі зростання концентрації антигену kа зменшується (Рис. 3Б). Це явище пов’язане із гетерогенністю сироваткових антитіл. Сироваткові антитіла – це суміш антитіл із різною афінністю до антигену. Коли ми додаємо до розчину антитіл перші порції антигену, в реакцію вступають найбільш афінні антитіла, для зв’язування яких потрібна найменша концентрація антигену. По мірі зростання концентрацій антигену його починають зв’язувати все менш афінні антитіла, і реальний графік Скетчарда – це інтегральна крива kа усіх популяцій сироваткових антитіл (а їх може бути до 300 на одну антигенну детермінанту). Прямий, класичний вид графіка Скетчарда можна отримати тільки для моноклональних (мієломних чи гібридомних) антитіл. Крім того, слід взяти до уваги, що ми маємо справу із бівалентними антитілами (а у випадку IgM – із п’ятивалентними). Зв’язування двох Fab не є рівнозначним: зв’язування першого може полегшити або, навпаки, ускладнити зв’язування інших.
Більшість природних антигенів не є моновалентними, а несуть декілька антигенних детермінант. Тому у фізіологічних умовах можна говорити не про афінність взаємодії у чистому вигляді, а про інтегральну, усереднену величину спорідненості антигену до антитіла, яка отримала назву авідності. Реально авідність вище суми афінностей, що до неї входять. Це легко бачити із математичних рівнянь.
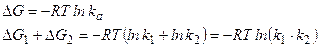 |
Термодинамічно, kа визначається різницею вільної енергії DG між станами антигену і антитіл, коли вони не взаємодіють, і після утворення комплексу. R – газова постійна, а Т – абсолютна температура. Для реакції антиген-антитіло DG = -31,5 - -43,2 КДж/моль (порівняно із –229,53КДж/моль для утворення двох ковалентних зв’язків Н-О у молекулі води), тобто реакція іде із зменшенням вільної енергії і є енергетично вигідною. Надлишок енергії використовується на необхідні конформаційні зміни в антигені та антитілі для досягнення оптимальної комплементарності. Зважаючи на те, що як антигенні детермінанти антигену, так і активні центри антитіл мають підвищену атомну мобільність, стає зрозумілим, що вони взаємно конформують один одного. Для зв’язування двох антигенних детермінант двома активними центрами антитіл сумма звільненої енергії пропорційна сумі логарифмів, тобто величини kа не складаються, а перемножуються.
Підвищення авідності при мультивалентному зв’язуванні антигену з антитілом має велике фізіологічне значення для підвищення ефективності зв’язування бактерій, їх токсинів, вірусів і т.і.
Експериментальне визначення Ка.
Згідно із рівнянням Скетчарда, визначити Ка можна, якщо вміти вимірювати концентрацію вільного і зв’язаного антигену у декількох точках титрування антитіл антигеном. Для цього можуть бути використані декілька експериментальних підходів.
1. Рівноважний діаліз.
Цей метод був запропонований для визначення Ка зв’язування антитіл із низькомолекулярними гаптенами, що можуть бути діалізовані через напівпроникну мембрану. Суть методу полягає в тому, що антиген вносять у дві камери, розділені мембраною. Між ними встановлюється концентраційна рівновага. При внесенні антитіл до камери 1 частина антигену зв’язується з ними і концентрація вільного антигену зменшується. Ініціюється переніс вільного антигену в камеру 1 із камери 2 і встановлюється нова рівновага. Тепер концентрація антигену у камері 2 дорівнює концентрації вільного антигену у камері 1, а кількість зв’язаного антигену можна розрахувати як різницю початкової концентрації внесеного і вільного антигену. Додаючи різні концентрації антитіл, можна знайти концентрації вільного і зв’язаного антигену для декількох точок і побудувати графік Скетчарда. Саме таким чином було вперше розраховано Ка для мієломних антитіл.
2. Гасіння флуоресценції.
Цей метод використовують тоді, коли зв’язування антигену змінює оптичні параметри антитіл, наприклад, гасить флуоресценцію залишків триптофану в активному центрі. Кожному значенню концентрації антигену відповідає своє значення флуоресценції і можна розрахувати концентрації вільного і зв’язаного антигену.
Методи визначення Ка є частиною великої групи методів вивчення взаємодії антигену з антитілом, які використовуються також для визначення присутності і кількості антигенів і антитіл у біологічних сумішах. Вони необхідні, наприклад, для діагностики різних фізіологічних станів організму. Так, діагностика вагітності – це часто визначення трофобласт-специфічного глобуліну у крові чи сечі жінки. Діагностика багатьох ендокринних порушень потребує точного визначення рівня того чи іншого гормону. При інфаркті міокарду однією із найбільш ранніх ознак некротичного процесу, що відбувається, є поява в крові міоглобіну серцевого м’язу, рівень якого корелює із об’ємом ураження. Використання для цього саме імунохімічних методів є переважним, оскільки вони базуються на високій специфічності взаємодії антиген-антитіло. Використання моноклональних антитіл дозволило максимально стандартизувати ці методи, зробити їх надійними та відтворюваними. З іншого боку, визначення антитіл у сироватках чи інших біологічних рідинах теж часто є необхідним, наприклад, для оцінки успішності вакцинації. Визначення антитіл проти віруса СНІДу є головним діагностичним тестом на зараження цим вірусом. Таким чином, визначення антигенів та антитіл часто є необхідним у клінічній практиці. Воно потребує дуже чутливих методів, тому що більшість гормонів, ростових факторів та антитіл знаходяться в організмі у слідових кількостях. Саме тому в останні десятиріччя багато уваги приділялося розробці чутливих методів визначення антигенів і антитіл.
Методи імунохімічного аналізу.
1. Преципітація.
Класичну преципітацію в розчині можна спостерігати при наявності полівалентного антигену та принаймні бівалентних антитіл. При поступовому додаванні антигену до антитіл (або навпаки) при певному їх співвідношенні розчин замутнюється утворенням осаду - преципітату. При подальшому додаванні антигену (антитіл) преципітат зникає. Поява преципітату обумовлена утворенням високомолекулярних комплексів, просторової сітки, що складається із багатьох молекул антигену і антитіл. Як при надлишку антигену, так і при надлишку антитіл утворюються низькомолекулярні розчинні комплекси (Рис.4). Співвідношення антиген-антитіло, коли спостерігається утворення преципітату, називається точкою еквівалентності.
Преципітат у розчині побачити і зафіксувати не так просто, тому було розроблено методи преципітації у гелі. Це дуже наочний метод. Він не має тієї чутливості, що сучасні радіоімунні чи імуноферментні методи, але у свій час відіграв значну роль в імунохімічному аналізі.
Суть методу полягає у тому, що реакція антиген-антитіло відбувається в агаровому чи агарозному гелі, структура якого дозволяє дифузію як антигену, так і антитіл. При досягненні точки еквівалентності в гелі утворюється дуга преципітації, яку легко побачити просто оком або підсилити спеціальними барвниками. При зміні концентрації антигену або антитіл в розчині, що вноситься, положення дуги преципітації змінюється. За формою та положенням дуги можна визначити приблизну концентрацію антитіл чи антигену, їх гомогенність (при наявності декількох антигенів і антитіл утворюється декілька дуг), а також спорідненість різних антигенів.
Дата добавления: 2015-08-04; просмотров: 1508;
