Уравнение Нернста. Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:
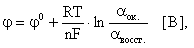
где: φ - электродный потенциал окислительно-восстановительного электрода, В;
φ0 - стандартный электродный потенциал этого электрода, В, R - универсальная газовая постоянная, равная 8,314 Дж/моль· К, T – температура в K; n - число электронов в уравнении электродной реакции, F - число Фарадея, равное 96500 Кл/моль, aок., a восст. - активности окисленной формы восстановителя (Меn+) и восстановленной формы окислителя (Ме) в электродной реакции. Подставив в уравнение Нернста T = 298 K, R, F и введя множитель 2,3 (переход к десятичным логарифмам), получим:
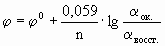
Уравнение Нернста для металлического электрода имеет вид:
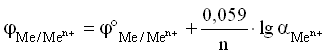
Для разбавленных растворов, в которых активности мало отличаются от концентрации (a » С):
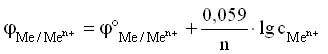
Величина j°Men+/Me0 называется стандартным ЭП металлического электрода. Значение ЭП металлического электрода равно величине стандартного ЭП металлического электрода при концентрации ионов металла в растворе, равной 1 моль/л. Стандартный электродный потенциал – равновесная разность потенциалов гальванического элемента, составленного из стандартного водородного электрода (электрод сравнения) и электрода, потенциал которого определяется в стандартных условиях.
Дата добавления: 2015-07-30; просмотров: 3457;
