Образование гальванического элемента. Электродвижущая сила (ЭДС)
Гальванический элемент – это система из двух электродов, в которой одновременно самопроизвольно могут, протекать пространственно разделенные процессы окисления и восстановления, при этом во внешней цепи возникает электрический ток и совершатся полезная работа.
Одним из первых был создан в 1836 Дж. Даниелем простой гальванический элемент, собранный из двух электродов: цинкового, погруженного в водный раствор сульфата цинка, и медного, погруженного в водный раствор сульфата меди (II). При замкнутой внешней цепи атомы цинка на поверхности цинкового электрода окисляются до ионов с высвобождением электронов: Zn→Zn2+ + 2e-. Эти электроны перемещаются по внешней цепи на медный электрод и восстанавливают ионы меди до атомов: Cu2+ + 2e-→Cu. Поток электронов во внешней цепи - это и есть ток, вырабатываемый элементом. Суммарная реакция, приводящая к химическому превращению и протеканию электрического тока, имеет вид:
Cu2+ + Zn →Zn2+ + Cu
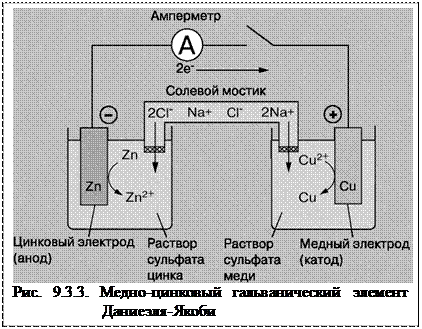
 Гальванический элемент часто представляют схематически, обозначая границу между электродом и электролитом вертикальной или косой чертой (| или / - обозначает границу раздела между проводниками 1-го рода), а солевой мостик - двумя косыми черточками (// - обозначает границу раздела между проводниками второго рода), тогда гальванический элемент схематично записываем так:
Гальванический элемент часто представляют схематически, обозначая границу между электродом и электролитом вертикальной или косой чертой (| или / - обозначает границу раздела между проводниками 1-го рода), а солевой мостик - двумя косыми черточками (// - обозначает границу раздела между проводниками второго рода), тогда гальванический элемент схематично записываем так:
А(-) Zn/Zn2+//Cu2+/Cu (+)К
где А и К это металлические электроды – анод и катод соответственно.
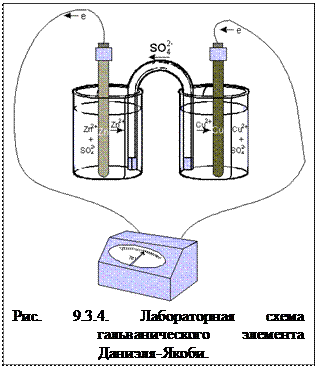
На рис. 9.3.4. приведена лабораторная схема того же элемента. Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами. Вследствие суммарной химической реакции в ГЭ возникает электрический ток, поэтому ее называют токообразующей. При замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. (Чтобы предотвратить явление, известное как “запирание ГЭ”, т.е. дать возможность ионам соли свободно перемещаться из одного раствора в другой, используют солевой мостик. Он представляет собой изогнутую (U- образную) стеклянную трубку, заполненную насыщенным раствором хлорида калия. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится цинковая пластина (или не высадятся из раствора все ионы меди).
Разность потенциалов катода и анода гальванического элемента называется его электродвижущей силой (ЭДС) и обозначается DЕ или Dj.
Дата добавления: 2015-07-30; просмотров: 1165;
