Определение электродных потенциалов металлов
Электродные потенциалы экспериментально определяют, измеряя напряжение гальванического элемента, составленного из исследуемого и электрода сравнения, потенциал которого известен. Схему элемента, в котором электродом сравнения является водородный электрод, записывают следующим образом: слева - водородный электрод, справа - измеряемый электрод.
Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
H2, Pt | H+ || Zn2+ | Zn,
а схема элемента для измерения потенциала медного электрода:
H2, Pt | H+ || Cu2+ | Cu,
напряжение гальванического элемента равно разности потенциалов правого и левого электродов:
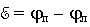
Так как потенциал левого электрода условно принимают равным нулю, то напряжение измеряемого элемента будет равно потенциалу правого электрода для водородно-цинкового элемента с обратным знаком:
DЕ = ЕH+/H0 - ЕZn2+/Zn0 –= 0,763 В,
т.е. водородный электрод будет катодом, а – цинковый анодом, во внешней цепи электроны будут перемещаются от цинкового электрода к водородному. Для медно-водородного электрода:
DЕ = ЕCu2+/Cu0 - ЕH+/H0 = 0,337 В,
медный электрод заряжен, относительно водородного, более положительно. Таким образом, во внешней цепи электроны перемещаются от водородного электрода к медному.
Теперь, зная потенциалы цинкового и медного электродов, можем рассчитать напряжение для элемента Даниэля-Якоби:
DЕ = ЕCu2+/Cu0 - ЕZn2+/Zn0 = + 0,337 –(-0,763) = 1,1 В,
9.3.7. Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
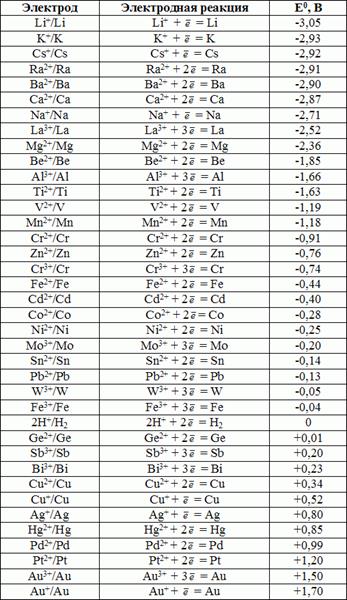
Стандартные электродные потенциалы металлических электродов в водных растворах приведены в справочной литературе. Величины стандартных ЭП металлов являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Ме/Меn+, тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Например, к наиболее сильным восстановителям (в водном растворе) относится литий (ЕLi+/Li0 = -3,04 B), а к наиболее сильным окислителям - ионы золота Au3+, Au+ (ЕAu3+/Au0 = +1,50 B, ЕAu+/Au0 = +1,69 B).
В таблице 9.1. приведены значения некоторых стандартных электродных потенциалов.
Полученный ряд значений получил условное название «ряд напряжений». В этом ряду металлы располагаются по мере уменьшения металлических свойств.
Таблица 9.1. Стандартные электродные потенциалы металлов.
Дата добавления: 2015-07-30; просмотров: 6871;
