Понятие об электродном потенциале, его образование в водных растворах элекролитов
В случае если металл активный (достаточно сильный восстановитель) ионы с поверхности переходят в раствор и металл становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл - раствор возникает двойной электрический слой (рис.9.3.2).
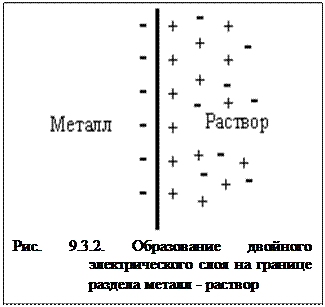
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом (ЭП) и обозначается ЕMen+/Me0. По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует дальнейшему окислению металла. Наряду с этой реакцией протекает обратная реакция - восстановление ионов металла до атомов.
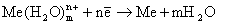
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала (ЕMen+/Me0) скорость прямого процесса будет равна скорости обратного процесса. При этом устанавливается равновесие:
Me + mH2O-ne-↔ Me(H2O)mn+
Для упрощения гидратационную воду обычно в уравнение реакции не включают и его записывают в виде:
Me + ne-↔ Men+
Равновесие имеет динамический характер, т.е. процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значения ЭП экспериментально определить невозможно. Однако можно определить их разность. Для характеристики электродных процессов пользуются относительными значениями ЭП. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого определен. Такие электроды называются электродами сравнения.
Дата добавления: 2015-07-30; просмотров: 1180;
