Электронные и электронно-ионные уравнения
Электронно-ионные уравнения, или полуреакции, применяются для уравнивания окислительно-восстановительных реакций, протекающих в растворах. Например, если расписать реакцию окисления сульфита калия перманганатом калия в кислой среде в ионном виде, то получим:
2КMn+7O4 + 5К2S+4O3 + 3Н2SO4= 2Mn+2SO4 + 6К2S+6O4 + 3Н2О
2К++2MnO4-+10К++5SO32-+6Н++3SO42-=2Mn+2+2SO42-+12К++6SO42-+3Н2О
2MnO4-+5SO32-+6Н+-=2Mn+2+5SO42-+3Н2О
Как видно, в результате реакции происходит изменение ионов MnO4- и SO32-. Первый ион теряет атомы кислорода, а второй приобретает. Этот перенос атомов кислорода происходит или с ионами водорода, или с гидроксид-ионами, или с молекулами воды.
При этом нужно знать, что:
1) избыток атомов кислорода связывается:
- в кислой среде с ионами водорода, образуя молекулы воды;
- в нейтральной и щелочной среде с молекулами воды, образуя гидроксид-ионы;
2) источником атомов кислорода являются:
- в кислой и нейтральной среде молекулы воды, которые переходят в ионы водорода;
- в щелочной среде гидроксид-ионы, которые переходят в молекулы воды.
Для данной реакции:
MnO4- теряет атомы кислорода в кислой среде, следовательно составляем полуреакцию и уравниваем её по количеству атомов:
MnO4-+8Н+-=Mn+2+4Н2О
Теперь нужно уравнять по зарядам, используя нужное количество электронов. Так как в левой части заряд +7, а в правой части заряд +2, то надо прибавить 5 электронов к левой части:
MnO4- + 8Н+-+5е- = Mn+2+4Н2О
Получили электронно-ионное уравнение восстановления перманганат-ионов.
Также составим электронно-ионное уравнение окисления сульфит-ионов SO32-:
SO32-+Н2О -- 2е- -=SO42-+2Н+
Ионы, не участвующие в окислительно-восстановительных процессах, называются ионами -"наблюдателями".
В данной реакции ионами - "наблюдателями" являются ионы калия и сульфат-ионы, входящие в состав серной кислоты. В электронно-ионных уравнениях частицы, не распадающиеся на ионы, записываются полностью. Например:
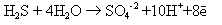
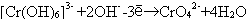
Дата добавления: 2015-07-30; просмотров: 1078;
