Уравнение Нернста
Зависимость окислительно-восстановительного потенциала, отвечающего полуреакции восстановления перманганат-иона в кислой среде (и, как уже отмечалось, одновременно полуреакции окисления катиона Mn2+ до перманганат-иона в кислой среде) от перечисленных выше определяющих его факторов количественно описывается уравнением Нернста
φ(MnO4–, H+ / Mn2+) = φo(MnO4–, H+ / Mn2+) + RT / 5Fln[MnO4–][H+]8 / [Mn2+].
В общем случае уравнение Нернста принято записывать в так:
φ(Ox/Red) = φo(Ox/Red) + RT/(nF) ln [Ox]/[Red], 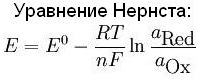
отвечающей записи полуреакции восстановления окислителя
Ox + ne- = Red
Каждая из концентраций под знаком натурального логарифма в уравнении Нернста возводится в степень, соответствующую стехиометрическому коэффициенту данной частицы в уравнении полуреакции, n – число принимаемых окислителем электронов, R – универсальная газовая постоянная, T – температура, F – число Фарадея.
Измерить окислительно-восстановительный потенциал в реакционном сосуде во время протекания реакции, т.е. в неравновесных условиях, невозможно, так как при измерении потенциала электроны должны передаваться от восстановителя к окислителю не непосредственно, а через соединяющий электроды металлический проводник. При этом скорость передачи электронов (силу тока)нужно поддерживать очень малой за счет приложения внешней (компенсирующей) разности потенциалов. Иначе говоря, измерение электродных потенциалов возможно только в равновесных условиях, когда прямой контакт между окислителем и восстановителем исключен.Поэтому квадратными скобками в уравнении Нернста обозначены, как обычно, равновесные (в условиях измерения) концентрации частиц. Хотя потенциалы окислительно-восстановительных пар во время протекания реакции нельзя измерить, их можно вычислить, подставляя в уравнение Нернста текущие, т.е. отвечающие данному моменту времени концентрации. Если рассматривается изменение потенциала по мере протекания реакции, то сначала это начальные концентрации, затем концентрации, зависящие от времени, и, наконец, после прекращения реакции, равновесные. По мере протекания реакции вычисляемый по уравнению Нернста потенциал окислителя уменьшается, а отвечающий второй полуреакции потенциал восстановителя, напротив, увеличивается. Когда эти потенциалы выравниваются, реакция прекращается, и система приходит в состояние химического равновесия.
Дата добавления: 2015-07-30; просмотров: 1870;
