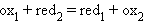Виды окислительно-восстановительных реакций
Все химические реакции, в которых электроны переходят от одного вещества или его части (восстановителя) к другому веществу или к другой части одного и того же вещества (окислителю), называются окислительно-восстановительными, или ред-окс процессами. Любому веществу-окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2) – окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
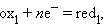
|
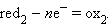
|
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
|
Если передача электронов от восстановителя к окислителю происходит во всем объеме раствора, то энергия химического взаимодействия рассеивается в окружающую среду в виде тепла (ΔH < 0).
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
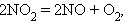
| ||
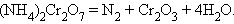
|
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
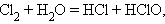
| ||
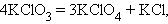
| ||
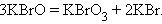
|
Дата добавления: 2015-07-30; просмотров: 1116;