Формулировка первого начала термодинамики
Первое начало термодинамики, или первый закон термодинамики, относится к важнейшим законам природы.
Известно около двух десятков формулировок первого начала. Однако все они эквивалентны, и, если принять в качестве основной любую из них, то все остальные окажутся следствиями из нее.
Обратимся к балансу энергии системы. С учетом принятой системы знаков (теплота, dQ, подводимая к системе и приводящая к увеличению ее энергии, принимается положительной, а работа, dW, совершаемая системой и, следовательно, уменьшающая ее энергию, - также положительна) можем записать выражение для баланса энергии в следующей форме:
dU=dQ - dW. (1 - 1)
Опыт показывает, что
работалюбого кругового процесса равна его теплоте.
Математическая форма записи этого утверждения такова:
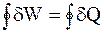 . (1 - 2)
. (1 - 2)
Приведенное утверждение и есть одна из многих формулировок первого начала термодинамики.
Из этой формулировки следует, что после любого кругового процесса внутренняя энергия не изменяется
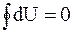 . (1 - 3)
. (1 - 3)
Следовательно, каким бы образом ни происходило изменение внутренней энергии при переходе системы из исходного состояния, которое в дальнейшем будет символически обозначаться (1), в конечное, для которого будет использоваться символ (2), изменение внутренней энергии всегда будет одним и тем же:
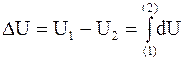 . (1 - 4)
. (1 - 4)
Для бесконечно малого приращения внутренней энергии, как величины не зависящей от процесса, используется символ d. Этим подчеркивается отличие изменения внутренней энергии от элементарной работы и теплоты, для которых применяется символ d. Теплота и работа зависят от процесса. Проиллюстрируем это утверждение следующим примером. Элементарная максимальная работа простой системы равна dW=PdV. При переходе системы от исходного состояния (1) до конечного состояния (2) (этим состояниям отвечают значения параметров P1, V1, T1 и P2, V2, T2) конечная работа определяется интегралом
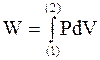 , (1 - 5)
, (1 - 5)
величина которого зависит от вида функции P=P(V). Так как каждая кривая соответствует своему процессу, то работа различных процессов при переходе из общего исходного состояния (1) в общее конечное состояние (2) окажется различной.
Теплота процесса перехода из состояния (1) в состояние (2) определяется равенством
Q=DU+W, (1 - 6)
в котором для одних и тех же начальных состояний и одних и тех же конечных состояний изменение внутренней энергии DU остается постоянным. Следовательно, изменение работы в зависимости от пути (процесса) влечет за собой зависимость теплоты Q от типа процесса (пути изменения параметров).
Внутренняя энергия представляет собой функцию параметров системы U=U(V,T).
Изменение внутренней энергии dU является полным приращением функции, определяемой параметрами системы V, T (давление не является независимой величиной, потому что оно является функцией этих параметров в соответствии с уравнением состояния), и его можно выразить следующим образом:
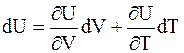 . (1 - 7)
. (1 - 7)
Используя другие пары параметров P,V или P,T, можно написать соответствующие выражения для полного приращения функции U.
Дата добавления: 2015-07-24; просмотров: 869;
