Теплоемкости системы
Теплоемкостьюсистемы в данном процессе называют отношение теплоты процесса к вызванному этой теплотой изменению температуры

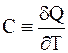 . (1 - 8)
. (1 - 8)
Символ тождества (º) означает, что выражение (1 - 8) является определением теплоемкости С.
С системой можно проводить неограниченное число процессов и для каждого должна быть своя теплоемкость.
Однако из всего множества в термодинамике принято выделять четыре важнейших процесса:
· процесс при постоянном объеме (V=const), или изохорический (изохорный) процесс;
· процесс при постоянном давлении (P=const), или изобарический (изобарный) процесс;
· процесс при постоянной температуре (T=const), или изотермический (изотермный) процесс;
· процесс без теплообмена (dQ=0), или адиабатический (адиабатный) процесс.
Теплоемкость изохорического процесса обозначается Cv, а изобарического процесса - Cp. Нетрудно заметить, что постоянной температуре, т.е. изотермическому процессу, соответствуют два значения теплоемкости: + ¥ и - ¥. Адиабатический процесс характеризуется теплоемкостью, равной 0.
Размерность теплоемкости Дж/моль/К означает, что она относится к 1 моль вещества.
Теплоемкости Сv и Сp реальных систем зависят от температуры. Обычно эта зависимость представляется в справочной литературе в виде степенных рядов.
Используя справочные данные по теплоемкостям, расчет теплоты процессов при постоянном давлении и при постоянном объеме проводят по формулам:
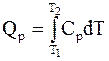 ; (1 - 9)
; (1 - 9)
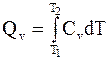 . (1 - 10)
. (1 - 10)
Дата добавления: 2015-07-24; просмотров: 686;
