КЛАССИФИКАЦИЯ КРИСТАЛЛОВ ПО ПРИРОДЕ ЧАСТИЦ И ТИПАМ СИЛ ВЗАИМОДЕЙСТВИЯ МЕЖДУ НИМИ
Существование устойчивой структуры твердого тела, как отмечалось в 4.1., обусловлено действием между его частицами сил притяжения и отталкивания. Независимо от природы этих сил они возрастают с уменьшением расстояния между частицами, но рост силы притяжения происходит значительно медленнее, чем силы отталкивания рис.4.5.
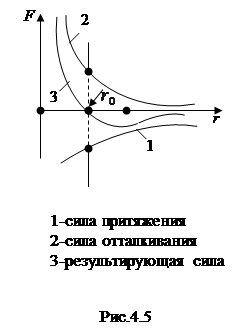 При значении r0 расстояния между частицами силы притяжения уравновешивают силы отталкивания и достигается устойчивое равновесное состояние, которому соответствует минимум потенциальной энергии взаимодействия (рис.4.1).
При значении r0 расстояния между частицами силы притяжения уравновешивают силы отталкивания и достигается устойчивое равновесное состояние, которому соответствует минимум потенциальной энергии взаимодействия (рис.4.1).
В зависимости от характера сил взаимодействия и природы частиц твердого тела различают четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
Ионные кристаллы образуют вещества, состоящие из полярных молекул. Например, в кристалл поваренной соли NaCl входят атомы Na и Сl, имеющие следующие распределения электронов по состояниям:
Na (Z=11) 1S22S22P63S1,
Сl (Z=17) 1S22S22P63S23P5.
Энергетически выгоден переход 3S электрона Na на 3Р оболочку атома Cl, так как внешние электронные оболочки обоих атомов оказываются полностью заполненными в соответствии с принципом Паули. При таком переходе атомы натрия и хлора превращаются в ионы: Na+, Cl-.
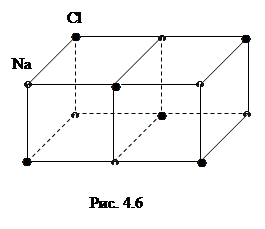 В узлах решетки кристалла NаCl располагаются чередуясь, ионы натрия и хлора (рис. 4.6).
В узлах решетки кристалла NаCl располагаются чередуясь, ионы натрия и хлора (рис. 4.6).
Электростатическое притяжение ионов ответственно за существование кристалла. Описанный тип связи называется гетерополярным.
В атомных кристаллах в узлах кристаллической решетки находятся атомы. Атомные кристаллы образуются при наличии так называемой ковалентной или гомеополярной связи. Ковалентная или гомеополярная связь возникает между двумя атомами за счет образования общей пары валентных электронов по одному от каждого атома.
Такой тип связи характерен для кристаллов элементарных полупроводников -германия и кремния. В атомах этих полупроводников распределения электронов по состояниям имеют вид:
Si (z = 14) 1S22S22P63S23P2
Ge (z = 32) 1S22S22P63S23P63D104S24P2
При образовании кристалла германия или кремния 4 валентных электрона
(3S23P2 или 4S24P2) образуют с четырьмя ближайшими атомами валентные связи, каждая из которых представляет для двух электронов общее электронное облако, охватывающее два атомных остатка (рис.4.7).
Силы, действующие между атомами в случае гомеополярной связи, называются обменными и имеют чисто квантово-механический характер.
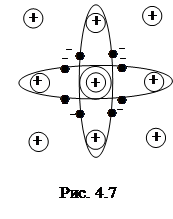 У металлических кристаллов в узлах кристаллической решетки находятся положительно заряженные атомные остатки (атомы без валентных электронов). Валентные электроны связаны с ядрами относительно слабо и имеют возможность свободно перемещаться в пределах всего кристалла, то есть обобществляются. Взаимодействие положительных узлов в узлах решетки с полностью обобществленными электронами создают силы связи, уравновешивающие силы отталкивания между ионами. Описанная связь называется металлической, так как она свойственна металлам.
У металлических кристаллов в узлах кристаллической решетки находятся положительно заряженные атомные остатки (атомы без валентных электронов). Валентные электроны связаны с ядрами относительно слабо и имеют возможность свободно перемещаться в пределах всего кристалла, то есть обобществляются. Взаимодействие положительных узлов в узлах решетки с полностью обобществленными электронами создают силы связи, уравновешивающие силы отталкивания между ионами. Описанная связь называется металлической, так как она свойственна металлам.
У молекулярных кристаллов в узлах кристаллической решетки находятся ориентированные определенным образом молекулы. Если молекулы полярные, то их связь в кристалле обеспечивается электрическим взаимодействием разноименных зарядов (ориентационное взаимодействие, рис.4.8)
 |
У некоторых неполярных молекул дипольный момент может индуцироваться под влиянием поля соседних молекул. При сближении индуцированные диполи взаимодействуют подобно полярным молекулам. Этот тип взаимодействия называется индукционным.
Существует еще один тип взаимодействия в молекулярных кристаллах – дисперсионный.
Механизм дисперсионного взаимодействия состоит в следующем. Дипольный момент нейтральной молекулы (или атома) равен нулю лишь в среднем. Мгновенные значения дипольного момента нейтральной молекулы (или атома) могут отличаться от нуля. При сближении двух атомов возникает согласованное движение их электронов и обеспечивается дисперсионное взаимодействие. Возникновение сил притяжения и отталкивания в молекулярных кристаллах (эти силы называются силами Ван-
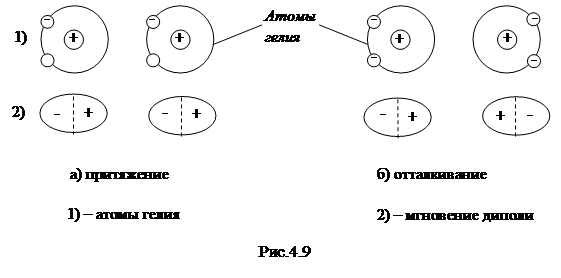 |
дер-Ваальса) поясняется на рис. 4.9 а,б.
Дата добавления: 2015-07-24; просмотров: 2293;
