ГЛАВА VII. Основы молекулярной генетики
7.1 Геномика, транскриптомика, протеомика.
Геномика — направление молекулярной генетики, изучающее структурно-функциональную организацию генов и геномов живых организмов.
Геномика сформировалась как особое направление в период создания первых проектов по секвенированию геномов некоторых видов живых организмов - в 1980—1990-х гг. Первым был полностью секвенирован геном бактериофага Φ-X174 (5 368 п.н.). Это событие произошло в 1977 г. В 1995 году был секвенирован геном бактерии Haemophilus influenzae (1,8 млн. п.н.). После этого были получены полные сиквенсы геномов еще нескольких видов, включая геном человека (2001 — первый черновой вариант, 2003 — первый завершенный релиз). Последний по времени релиз – 37.1 - опубликован в августе 2009 г. В нем аннотировано 34533 гена. Хотелось бы отметить, что развитие геномики стало возможно не только благодаря совершенствованию биологических и физико-химических методов, но и благодаря появлению более мощной вычислительной техники, которая позволила работать с огромными массивами данных, и более совершенного программного обеспечения. Протяженность геномов у живых организмов очень часто измеряется миллиардами пар оснований (геном человека состоит из 3 млрд. п. н.), что предполагает необходимость применения существенных компьютерной мощностей для адекватной обработки содержащейся в них информации.
Структурная геномика – раздел геномики, изучающий структуру генов и геномов. Особое внимание уделяется внутреннему строению гена, составу и расположению регуляторных последовательностей, особенностям молекулярной организации хромосом и хромосомных районов, общим принципам структурирования последовательностей геномов.
Функциональная геномика изучает механизмы работы генов и других функционально активных элементов генома. Процессы экспрессии генов и ее регуляции при помощи близких и удаленных элементов генома находятся в центре внимания этой дисциплины.
Сравнительная (эволюционная) геномика — раздел геномики, предметом которого являются эволюционные отношения генов и геномов. Вопросы гомологии (общности происхождения двух или более структур), эволюционного консерватизма и дивергенции (расхождения в процессе эволюции) наиболее характерны для этого раздела.
Информация о структурно-функциональной организации генома человека хранится на веб-странице http://www.ncbi.nlm.nih.gov/guide/genomes-maps.
Транскриптомика – как и следует из ее названия, наука о транскриптоме.
Транскриптомом называют совокупность всех транскриптов, которые синтезируются в одной клетке или группе клеток (в том числе мРНК и некодирующие РНК). Понятие транскриптом может обозначать полный набор транскриптов, синтезируемых в данном организме, или специфический набор транскриптов (молекул РНК), представленный в клетках определенного типа.
Если геном у всех клеток одной линии, как правило, одинаков, то транскриптом может быть весьма изменчив и зависит от условий окружающей среды. Понятие транскриптом отражает профиль экспрессии генов в данный момент времени, поскольку включает в себя все транскрипты данной клетки. Наиболее часто в экспериментах по изучению транскриптома используют биочипы (метод ДНК-микроаррей, позволяющий анализировать уровни транскрипции десятков тысяч генов одновременно) и полимеразную цепную реакцию в реальном времени, которая позволяет давать точную количественную оценку экспрессии отдельных генов. Существуют базы данных по профилям экспрессии тысяч генов в различных органах и тканях при разных воздействиях (например, http://www.ncbi.nlm.nih.gov/guide/genes-expression).
Протеомика — это наука, изучающая белки и их взаимодействия в живых организмах. Учёные, работающие в области протеомики, исследуют биосинтез, посттрансляционные модификации, взаимодействия белков друг с другом и с другими веществами.
Белки служат для выполнения огромного числа функций в организме:
- Энзимная (ферментная). Многие белки служат катализаторами биохимических реакций, протекающих в живых организмах;
- Транспортная. Некоторые белки, такие как гемоглобин, трансферрин и др. переносят различные вещества от одних клеток, тканей и органов к другим;
- Структурная. Белки входят в состав подавляющего большинства структурных компонентов клеток и тканей живых организмов. Например, коллаген и эластин обеспечивают фиброзную основу соединительных тканей у животных;
- Резервная (запасная) Некоторые белки, такие как казеин, являеюся главным источником аминокислот для организмов детёнышей млекопитающих;
- Регуляторная. Гормоны, принимающие участие в регуляции многих процессов, протекающих в живом организме, по своей химической природе являются белками.
- Рецепторная. Существуют белки, встроенные в мембраны клеток, которые распознают химические сигналы, передаваемые другими клетками;
- Моторная. Сократимые белки, такие как миозин, который играет большую роль в движении мышц;
- Защитная. Белками являются антитела, которые защищают организм от болезней.
Белки синтезируются через посредника — рибонуклеиновую кислоту (РНК), структура которой определяется последовательностью ДНК. Процесс реализации генетической информации о структуре белка или РНК называется экспрессией. Молекулы белков представляет собой высокомолекулярные органические вещества, состоящие из одной или нескольких аминокислотных цепочек. Порядок, в котором выстраиваются аминокислоты, диктуется последовательностью нуклеотидов в ДНК.
Наиболее крупное достижение последних лет - картирование генома человека. По данным последнего релиза (37.1 от августа 2009 г.) в аутосомах находится 32593 генов, в половых хромосомах – 2003 гена и в митохондриях – 37 генов. Количество белков в человеческом организме примерно в 10 раз больше количества генов. По оценкам большинства авторов, их насчитывается более 300 000, а число белок-белковых взаимодействий и вовсе не поддается подсчету. Наиболее известная база данных по протеомике человека: http://www.ncbi.nlm.nih.gov/protein.
Многие болезни могут быть прослежены до изменений, происходящих на уровне белков. К примеру, известно, что при серповидно-клеточной анемии аномальный белок гемоглобин вызывает изменение формы красных кровяных телец. Аномальные эритроциты имеют серповидную форму. Серповидноклеточная анемия обусловлена мутацией, приводящей к замене глутаминовой кислоты на валин в бета-цепи гемоглобина (гемоглобин S). Это заболевание является классическим примером приспособительного значения мутаций – гетерозиготы по замене глутаминовой кислоты на валин в бета-цепи гемоглобина более устойчивы к малярии, поэтому частота ее встречаемости выше в географических районах распространения малярийного плазмодия.
Часто после синтеза (трансляции), для того, чтобы выполнять определенные функции в организме, белки требуют модификации. Например, белки, которые вызывают образование кровяных тромбов, остаются неактивными до тех пор, пока не претерпевают соответствующих изменений. Следовательно, неправильная посттрансляционная модификация также является причиной неправильного функционирования белков.
Причиной многих заболеваний человека являются модификации белков и изменения характера их взаимодействий. Результаты исследований в области протеомики в последние годы все чаще применяются в биофармакологии, которая получила благодаря этому надежный теоретический фундамент. Сегодня более 95% всех имеющихся на рынке лекарственных средств оказывают свое действие именно на белки. Системные подходы протеомики помогают гораздо эффективнее идентифицировать и оценивать новые целевые белки, а, следовательно, ускорить разработку новых диагностических систем и терапевтических средств и сделать их более эффективными.
7.2 Клонирование нуклеиновых кислот
Клонирование нуклеиновых кислот – получение большого числа копий интересующей последовательности в форме воспроизводимых в живых организмах структур – вирусов, плазмид, искусственных хромосом. Введение в организм чужеродных генов обычно используют для получения продукта этого гена — РНК или, чаще всего, белка. Принципиально возможно применение метода для генной терапии.
Клонировать можно как отдельные фрагменты генома, так и мРНК. В последнем случае применяют специальный фермент - обратную транскриптазу, которая позволяет получить ДНК-копию с РНК-матрицы. Полученные путем обратной транскрипции молекулы ДНК называют комплементарной ДНК (кДНК). Их и лигируют в векторы.
Клоны, полученные из отдельных тканей, хромосом или геномов группируют в тканеспецифические, хромосомоспецифические или геномные библиотеки.
7.3 Гибридизация нуклеиновых кислот
Гибридизация нуклеиновых кислот — это образование in vitro двуцепочечных молекул нуклеиновых кислот из комплементарных одноцепочечных молекул. Если гибридизуемые молекулы полностью комплеменетарны, процесс происходит достаточно быстро. При гомологии (общем происхождении) изучаемых последовательностей, которая выражается в определенном проценте идентичности оснований, процесс может потребовать варьирования условий гибридизации. Возможна гибридизация ДНК-ДНК и ДНК-РНК. Процесс гибридизации ДНК/ДНК проводится следующим образом. Двуцепочечную ДНК разогревают в соответствующем буфере. На этом этапе водородные связи между комплементарными азотистыми основаниями становятся термодинамически невыгодными и цепочки расходятся. Происходит денатурация ДНК. Препарат денатурированной ДНК затем смешивается с другой денатурированной ДНК. Далее эта смесь медленно охлаждается. В это время одноцепочечные ДНК отжигаются друг на друга (образуются водородные связи между комплементарными основаниями) и образуется гибридная молекула ДНК.
Анализ скорости ренатурации одноцепочечных ДНК служит для оценки сходства и различия последовательностей ДНК разных видов живых организмов или разных особей одного вида.
Дот-блот-гибридизация проводится в одной точке. На фильтр наносят исследуемый образец. ДНК-зонд метят радиактивно, иммуноферментно или иммунофлуоресцентно. Наличие положительного гибридизационного сигнала свидетельствует о наличии в образце последовательности, полностью или частично идентичной молекуле ДНК-зонда.
Блот-гибридизация по Саузерну служит для выявления определенной последовательности ДНК в образце, которая полностью или частично идентична молекуле ДНК-зонда. Этот метод сочетает электрофорез в агарозном геле для фракционирования ДНК с методами переноса полученных фрагментов ДНК на мембранный фильтр для гибридизации. Метод получил свое название по имени изобретателя, английского биолога Э. Саузерна.
Нозерн блот-гибридизация (в английском названии метода – игра слов southern – южный, northern – северный) – подобна блот-гибридизации по Саузерну, но в качестве мишени используют кДНК. Метод служил для выявления и количественной оценки уровня транскрипции отдельных генов до распространения метода ПЦР с обратной транскрипцией.
7.4 Геномные библиотеки.
Возможность быстрого получения препаративных количеств ДНК протяженных (более 30 т.п.н.) фрагментов генома является необходимым условием большинства экспериментов по молекулярно-генетическому и цитогенетическому анализу геномов. Гридированные геномные библиотеки, то есть имеющие адресное указание индивидуальных клонов, позволяют получать протяженные фрагменты ДНК, содержащие интересующую исследователей последовательность, и широко используются для анализа генома с использованием различных подходов.
Первая генетическая система для масштабного клонирования протяженных фрагментов генома была создана Бурке в 1987 году. Она была основана на искусственных хромосомах дрожжей (YACs), включающих центромеру, теломеры, автономно-реплицирующиеся последовательности, сайт клонирования и гены селективных маркеров. Система позволяла клонировать нуклеотидные последовательности до 1000 т.п.н. Поскольку в начале 90-х годов интенсивно проводилось секвенирование генома человека, такие системы были быстро востребованы и использованы для создания геномных библиотек. Однако, существенные недостатки этого рода библиотек — высокий уровень химеризма (когда в одном клоне объединены разные участки генома), нестабильность геномной вставки и трудность приготовления препаративных количеств клонированных последовательностей ДНК — не позволили их использовать в качестве основного инструмента геномного клонирования. Большое количество тандемных (ориентированных в одном направлении) повторов генома млекопитающих приводило в дрожжевой системе к сайт-специфической рекомбинации и потере фрагментов вставки, либо к образованию химерных клонов, то есть клонов, содержащих фрагменты ДНК из разных областей генома–донора. Цитологически химерные клоны выявляются при гибридизации in situ вследствие локализации в двух и более сайтах.
Поскольку прокариотические системы рекомбинации оставляют меньше вероятности нежелательных обменов, кроме того эписомы прокариот отличаются относительной стабильностью и могут существовать в суперскрученной форме, бактерии оказались более привлекательными как организмы–хозяева для геномных клонов. Плазмидные векторы не только проще хромосомных эукариотических векторов (не содержат центромеры, теломеров, и, следовательно, конструирование библиотек с ними менее трудоемко), но и позволяют существенно упростить процедуру выделения клонированной ДНК из основанных на них клонов путем полного разрушения хромосомной ДНК.
Первые геномные банки с использованием клеток кишечной палочки Escherichia coli были основаны на группе векторов — производных фага лямбда. Существуют фаговые векторы традиционной структуры, представляющие собой молекулы ДНК, способные только к литическому расщеплению in vitro. Космидные векторы формально являются дефектными фагами — плазмидами разных типов, содержащими cos-участки фага лямбда и не способными к лизису. Наконец, фагмидный (фаг + плазмида) вектор, существенной особенностью которого является способность к литическому развитию in vivo, поддерживается в виде плазмиды. Все подобные конструкции широко используются для получения клонотек и банков генов. Их общим недостатком является довольно большое число клонов (до 106), необходимое для уверенного представления любого фрагмента генома млекопитающих или птиц при сравнительно небольшом размере вставки — 20–40 т.п.н.
Особо стоит упомянуть космиды – плазмиды, содержащие сегмент ДНК фага λ с соединенными липкими концами (cos-сайты). Важной чертой большинства космидных векторов для клонирования является их способность включать вставки до 45 т.п.н. Если кольцевую космидную ДНК разрезать по какому-то уникальному сайту, смешать с фрагментами ДНК, содержащими липкие концы, и произвести отжиг, то образуются длинные конкатемеры (молекулы, состоящие из крупных повторяющихся блоков). При смешении этих конкатемеров с белками, осуществляющими упаковку фага λ, они разрезаются по cos-сайтам, и ДНК упаковывается в головку фага. Этот процесс позволяет отобрать вставки большой протяженности, так как для того, чтобы ДНК упаковывалась в головку фага, расстояние между cos-сайтами должно быть 38–52 т.п.н. Такая смесь может содержать фрагменты вовсе без вставки или с несколькими повторяющимися вставками, что отражается на качестве полученной библиотеки и затрудняет ее применение для геномного анализа. Реципиентные клетки приобретают упакованные космиды в результате инфицирования «фальшивыми» фаговыми частицами, причем этот процесс более эффективен, чем трансфекция плазмидной ДНК. Попав в клетку–хозяина, рекомбинантная ДНК амплифицируется и сохраняется в виде плазмиды. Полученные рекомбинантные клоны могут быть гридированы – выращены на платах с указанием координат каждого клона. Получение отпечатков (реплик) на нитроцеллюлозных или других фильтрах для переноса клонов с последующим разрушением клеточных стенок бактерий и отмыванием белков позволяет проводить скринирование таких библиотек при помощи обычной дот-блот ДНК-ДНК гибридизации. Недостаткам космидных геномных библиотек является относительно (по сравнению с искусственными хромосомами дрожжей) небольшая величина вставки (до 45 т.п.н.) и, следовательно, большой объем библиотеки (для геномов млекопитающих около 2 x 105 клонов). Для того чтобы совместить преимущества космидных библиотек (высокая стабильность ДНК-клонов, относительно низкий уровень химеризма, простота конструирования, удобство выделения ДНК) и дрожжевых библиотек (большая длина вставки и компактность всей библиотеки), было разработано две системы клонирования – на основе искусственных хромосом бактерий (BAC) и искусственных хромосом фага P1 (PAC). Впервые PAC вектор (pCYPAC-1) был использован для переноса рекомбинантной ДНК в клетки E. coli при помощи электропорации. Разделенные при помощи пульс-электрофореза фрагменты геномной ДНК человека были упакованы в головки частиц бактериофага P1. Заражение такими фаговыми частицами штамма E. coli, экпрессирующего рекомбиназу Cre, привело к возникновению эписомных копий генома рекомбинантных фаговых частиц. Полученная геномная библиотека содержала 15000 клонов со средним размером вставки 130–150 т.п.н. Тридцать четыре клона были гибридизованы на митотических хромосомах методом FISH, при этом не было выявлено ни одного случая химеризма. Продолжительное культивирование бактерий не выявило нестабильности вставки на примере 20 клонов.
Искусственные хромосомы бактерий (BACs) основаны на F-факторе (факторе фертильности) – низкокопийной плазмиде, которая существует в бактериальных клетках в суперскрученной кольцевой форме и может включать вставку до 500 т.п.н. Репликация фактора фертильности жестко контролируется клеточными механизмами, что существенно снижает уровень рекомбинации в эписомах этого рода. Кроме того, геномная ДНК вида–донора находится практически все время в суперскрученном состоянии, следовательно вероятность нежелательных обменов между фрагментами вставки теоретически приближается к нулю. Первая такая библиотека была получена на основе вектора pBAC108L, включающего фактор фертильности и cosN-сайт. Размер вставки варьировал от 10 до 300 т.п.н., составляя в среднем 100 т.п.н. Стабильность вставки (по признаку сохранения профиля рестрикционных фрагментов) подтверждена в течение 100 поколений бактериальных клеток. Проверка клонов на химеризм методом гибридизации in situ позволила обнаружить только один случай обмена из 28 случайно выбранных трансформантов. Дальнейшие работы с использованием этой библиотеки также показали низкую частоту транслокаций. Следует отметить в среднем меньшую длину клонированных фрагментов в системах искусственных хромосом бактерий по сравнению с дрожжевыми и основанными на бактериофаге P1. Однако, указанные выше недостатки дрожжевых систем не позволяют им конкурировать с бактериальными. Преимуществом же BAC-библиотек перед PAC-библиотеками является относительная простота их конструирования: исключается использование бактериофагов, перенос донорной ДНК проводится при помощи обычной трансформации. Таким образом, оптимальными системами для клонирования протяженных геномных последовательностей более 50 т.п.н. признаны искусственные хромосомы бактерий, а для фрагментов менее 50 т.п.н. (которые имеют преимущества для использования в некоторых исследованиях геномов) таковыми остаются космиды.
7.5 Полимеразная цепная реакция (ПЦР).
Полимеразная цепная реакция (ПЦР) применяется при необходимости многократного увеличения малых концентраций отдельных фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (образце). Применение ПЦР настолько многообразно, что одно перечисление способов приложения этого метода может занять существенный объем текста. В наше время в принципе любую последовательность ДНК можно получить в препаративных количествах зная только по 20-30 нуклеотидов на ее границах.
Принцип полимеразной цепной реакции заключается в многократном избирательном копировании (амплификации) определённого участка ДНК, проводимом in vitro с помощью особой ДНК-полимеразы (например, полимеразы taq), выделенной из экстремально термофильных бактерий (Рисунок VII, 1). Особая термостабильность этого фермента позволяет проводить денатурацию двунитевой ДНК при 95°С без потери активности. Условия реакции подбираются так, чтобы амплифицировался только заданный фрагмент ДНК и только в том случае, если он присутствует в исследуемом образце. После денатурации ДНК короткие (18—30 н.п.) синтетические олигонуклеотиды, называемые праймерами, гибридизуются ДНК-матрицей согласно принципу комплементарности пар оснований, что обусловливает специфичность ПЦР. Температура на этой стадии 50-65°С, точная температура зависит от последовательностей праймеров исходя из их нуклеотидного состава. Эта стадия называется отжиг или гибридизация. Каждый из праймеров комплементарен участку одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого фрагмента. Затем температуру доводят до 72°С – оптимума для работы taq-полимеразы. Это - стадия полимеризации. Денатурацию, отжиг и полимеризацию (каждая проводится от нескольких секунд до полутора минут) повторяют 20-35 раз. Таким образом, число копий амплифицируемого фрагмента увеличивается в 2n раз, где n – число циклов. Затем реакционную смесь инкубируют несколько минут при 72°С, чтобы полимераза смогла достроить недополимеризованные участки – стадия элонгации. Заключительная стадия – хранение – проходит при 4°С. Визуализацию результатов обычно проводят путем электрофореза в агарозном геле с окраской ДНК флуорохромом этидиум бромид (Рисунок VII, 2).
Для анализа экспрессии генов применяют РТ-ПЦР – полимеразную цепную реакцию на матрице кДНК, полученной путем обратной транскрипции мРНК.
С использованием специальных приборов ПЦР можно наблюдать в режиме реального времени (Рисунок VII, 3). Существует несколько вариантов проведения такой реакции. Один из них – ПЦР, в которой в реакционную смесь, помимо традиционных компонентов, добавляют интеркалирующий краситель SYBR GREEN. Сканирующий луч измеряет уровень флуоресценции красителя, связывающегося только с двунитевой ДНК, который прямо пропорционален числу копий амплифицированного фрагмента. Определение номера цикла, на котором уровень флуоресценции достоверно превысит фоновый (точки Ct) позволяет проводить количественные сравнения ДНК в различных образцах (Рисунок VII, 4). Поскольку для каждого фрагмента существуют своя температура денатурации (плавления), наличие только одного пика на кривой плавления свидетельствует о специфичности реакции (Рисунок VII, 5).
Отличие ПЦР от процесса репликации, проходящего в клетках живых организмов, состоит в том, что полимеразная цепная реакция позволяет амплифицировать сравнительно короткие участки ДНК (не более 3000 пар оснований). Использование смеси нескольких полимераз, например, Taq и Pvu, при определенных условиях возможна амплификация фрагментов ДНК длиной 20 – 40 т.п.н., однако эти фрагменты всё равно значительно короче хромосомной ДНК эукариотической клетки.

Рисунок VII, 1. Схема ПЦР.
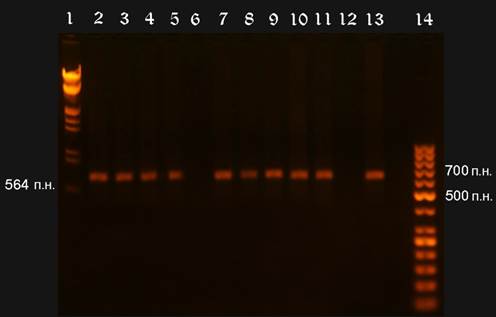
Рисунок VII, 2. Электрофореграмма результатов ПЦР. Фото автора.

Рисунок VII, 3. Амплификатор iQ (Biorad). Прибор может быть использован как для ПЦР в реальном времени, так и для обычной (конвенционной) ПЦР.

Рисунок VII, 4. Примеры графиков количественного анализа нуклеиновых кислот при помощи ПЦР в реальном времени.

Рисунок VII, 5. Примеры кривых плавления при ПЦР в реальном времени.
7.6 Секвенирование ДНК.
Секвенирование нуклеиновых кислот — определение их первичной нуклеотидной последовательности.
В настоящее время для секвенирования широко используется дидезоксинуклеотидный метод, или метод «обрыва цепи», разработанный Ф. Сэнгером в 1977. До начала секвенирования производят ПЦР-амплификацию участка ДНК, последовательность которого требуется определить, с использованием в качестве предшественников молекулы дидезоксинуклеозидтрифосфатов (ддНТФ). При дидезокси-секвенировании происходит гибридизация синтетического олигонуклеотида-праймера длиной 17—25 п.н., поставляющего 3'-гидроксильную группу для инициации синтеза цепи, комплементарной матрице, со специфическим участком одной из цепей секвенируемого фрагмента. Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезоксинуклеотида - дАТФ, дЦТФ, дГТФ и дТТФ (один из них — меченный радиоактивным изотопом) - и один из четырех 2',3'-дидезоксинуклеотидов (ддАТФ, ддТТФ, ддГТФ или ддЦТФ). Затем проводят один цикл амплификации. Дидезоксинуклеотид включается по всем позициям в смеси растущих цепей, и после его присоединения рост цепи сразу останавливается. В результате этого в каждой из четырех пробирок образуется уникальный набор полинуклеотидов разной длины. В четырех пробирках можно найти последовательности ДНК, различающиеся на 1 нуклеотид. Далее в пробирки добавляют формамид для денатурации фрагментов ДНК и проводят электрофорез в полиакриламидном геле на четырех дорожках. После разделения фрагментов ДНК проводят радиоавтографию, которая позволяет «прочесть» нуклеотидную последовательность секвенируемого сегмента ДНК (Рисунок VII, 6).
В настоящее время дидезоксинуклеотиды метят четырьмя разными флуоресцентными красителями и проводят ПЦР в одной пробирке. Затем во время электрофореза в полиакриламидном геле луч лазера в определенном месте геля возбуждает флуоресценцию красителей, и детектор определяет, какой нуклеотид в настоящий момент мигрирует через гель. Современные приборы используют для секвенирования ДНК капиллярный электрофорез (Рисунок VII, 7).
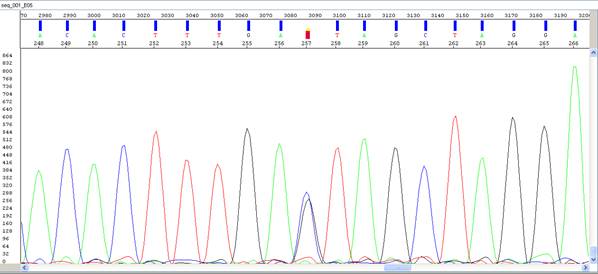
Рисунок VII, 6. Элекрофореграмма результатов секвенирования фрагмента ДНК. Буквами обозначены соответствующие нуклеотиды: A – аденин, C – цитозин, T – тимин, G – гуанин, символ S обозначает вариант мононуклеотидного полиморфного сайта (SNP) цитозин – гуанин.

Рисунок VII, 7. Генетический анализатор AB 3130 (Applied Biosystems). Прибор используют для секвенирования и генотипирования по молекулярным маркерам.
7.7 Сборка сиквенсов геномов
Метод дробовика (шотган-секвенирование/клонирование) может быть применен для сборки сиквенсов протяженных фрагментов ДНК, в том числе хромосом и геномов. В этом случае ДНК случайным образом фрагментируют. Полученные мелкие сегменты секвенируют обычными методами, например методом Сэнгера. Полученные последовательности перекрывающихся случайных фрагментов ДНК собирают с помощью специальных программ в одну большую последовательность. Существенную трудность при сборке представляют повторяющиеся последовательности ДНК, так как они имеют участки перекрывания с большим числом фрагментов. Для геномов прокариот и низших эукариот метод дробовика оказался подходящим. Геном человека содержит огромное количество (больше половины) разного типа повторяющихся последовательностей. Поэтому для получения совершенной сборки необходимо применение протяженных геномных клонов.
Сборка при помощи протяженных геномных клонов проводится в несколько этапов. Вначале необходимо создать несколько геномных библиотек с покрытием 5-10 эквивалентов генома (раздел 7.4). Затем клоны организуют в контиги (Рисунок VII, 8). Контиг – это совокупность взаимно перекрывающихся геномных клонов. Для сборки контигов обычно используют геномный фингерпринтинг. Этот метод подразумевает разрезание ДНК клонов специальными ферментами – рестриктазами и блот-гибридизацию по Саузерну с использованием в качестве зондов минисателлитных последовательностей (небольших повторов с повторяющейся единицей 7 и более нуклеотидов, имеющих более 1000 сайтов локализации в геноме человека). В результате получается индивидуальный набор гибридизующихся с зондом фрагментов для каждого клона. При этом совпадение длин нескольких фрагментов двух клонов говорит о наличии участка перекрывания. Попарное определение участков перекрывания позволяет получить контиг, соответствующий достаточно протяженному участку хромосомы. Затем методом FISH (раздел 5.5) определяют локализацию контигов на хромосоме. Протяженные геномные клоны фрагментируют с использованием рестриктаз. Полученные последовательности длиной 500-700 п.н. встравают в плазмидные векторы. Эта процедура называется субклонирование. Затем субклонированные последовательности секвенируют и при помощи компьютерных программ собирают сиквенс всего геномного клона. Объдинив сиквенсы геномных клонов получают сиквенсы контигов, а объединив последние – сиквенсы хромосом (Рисунок VII, 9). Следует отметить, что некоторые районы хромосом, состоящие почти исключительно из повторов (например, центромерные районы), технически не поддаются клонированию и секвенированию и образуют пробелы (гэпы) на картах геномов.

Рисунок VII, 8. Образец контига геномных клонов.

Рисунок VII, 9. Фрагмент геномной последовательности.
7.8 Биоинформатика и системная биология
Биоинформатика или вычислительная биология — один из разделов биологии, предметом которого являются молекулярные процессы, но в данном случае исследования проводятся не in vitro, а in silico, т.е. не в пробирке, а при помощи компьютеров.
Под биоинформатикой понимают любое использование компьютеров и программного обеспечения для анализа биологических данных. На практике часто это понятие сужается и включает в себя только использование компьютеров для обработки экспериментальных данных по структуре биологических макромолекул (белков и нуклеиновых кислот) с целью получения биологически значимой информации.
В биоинформатике используются методы прикладной математики, статистики и информатики. Исследования в областях биоинформатики и системной биологии зачастую пересекаются. Основные усилия исследователей, работающих в области биоинформатики, направлены на изучение геномов, анализ и предсказание структуры белков, предсказание взаимодействий различных белков друг с другом и другими молекулами, а также реконструкция процессов эволюции.
Биоинформатика помогает ученым, используя последовательности ДНК, прогнозировать структуры и возможные функции кодируемых ими белковых молекул, и, таким образом, связывает геномные и протеомные проекты.
Велика роль биоинформатики в процессе маркировки генов и других объектов в последовательности ДНК.
Эволюционная биология исследует происхождение и появление видов, также как их развитие с течением времени. Методы биоинформатики активно используются биологами эволюционистами для решения целого ряда задач:
- изучение эволюции большого числа организмов, включая эволюцию молекул ДНК, а не только строения или физиологии;
- сравнение целых геномов, что позволяет изучать такие явления как дупликация генов, горизонтальный перенос генов, и предсказывать бактериальные специализирующие факторы;
- построение компьютерных моделей популяций, с целью предсказания поведения систем во времени.
Системная биология включает в себя целый ряд существующих и перспективных направлений в биологии. Системную биологию можно определить как междисциплинарную науку о жизни, изучающую сложные взаимодействия в живых системах и использующую новый подход в биологии: холизм вместо редукционизма. Задачами системной биологии являются исследование и моделирование свойств сложных биологических систем, которые нельзя объяснить суммой составляющих ее свойств.
Для верификации создаваемых моделей системная биология работает с самыми различными типами экспериментальных данных, описывающих как отдельные составляющие, так и систему в целом. В системной биологии часто используются данные, полученные в других областях биологии: биохимии, биофизики, молекулярной биологии.
Биологические системы являются очень сложными объектами. Для их описания используется огромное количество параметров, переменных и уравнений, а значит, развитие современной системной биологии невозможно без использования компьютерных технологий.
Контрольные вопросы и задания к главе VII
Заполните пропуски в следующих утверждениях:
1.С целью размножения (амплифицирования) и получения в чистом виде тех или иных генов фрагменты эукариотической ДНК могут быть встроены в специально подготовленные бактериальные вирусы или плазмиды, называемые __________.
2.Отдельная колония бактерий, которая содержит плазмиду с включенным в нее фрагментом ДНК человека или другого живого организма называется _________; набор таких бактерий, представляющий весь геном человека или другого живого организма, составит ____________.
3.Считается, что мутации, не наследуемые согласно правилам Менделя, проявляют ______________ и локализованы, по-видимому, в генах органелл.
4. В генах высших эукариот короткие сегменты кодирующей ДНК, которые называются ___________, обычно разделены длинными последовательностями некодирующей ДНК, которые называются _____________.
Дополнительная литература к главе VII
Сингер М., Берг П. Гены и геномы: В 2-х т. Т. 1// М.: Мир. 1998. – 373 С.
Дата добавления: 2015-07-22; просмотров: 1642;
