ГЛАВА X. Цитогенетическая и молекулярно-генетическая диагностика наследственных заболеваний человека
10.1 Диагностика хромосомных болезней
Диагностика хромосомных болезней может проводиться у взрослых индивидуумов любого возраста или пренатально (до рождения) - в этом случае при наличии патологии может быть рекомендовано прерывание беременности. Для проведения пренатальной диагностики требуются показания – наличие хромосомных аномалий в семье, возраст матери старше 35 лет, долговременный контакт с мутагенами, ультразвуковые (например, увеличение межворотникового расстояния) или биохимические маркеры (например, сывороточные) маркеры хромосомной патологии плода. Обычно на 10-11 неделе проводят биопсию хориона - небольшое количество хориональной ткани отсасывается шприцем через катетер или длинную иглу. Вероятность выкидыша при этой процедуре 2-6%. Во втором триместре использую плацентоцентез (позднюю биопсию хориона) – процедура аналогична хориоцентезу, но объектом лабораторного исследования при этом являются клетки плаценты. На 15-16 неделе иногда проводят амниоцентез - из амниотической жидкости выделяют находящиеся в ней клетки плода (слущенные клетки кожи плода, эпителиоциты из мочевыводящих путей и т.д.), которые культивируют для получения препаратов хромосом. Риск выкидыша при этом способе – около 1 %. Обычно клеток выделяется мало, размножить их в значительной степени затруднительно, поэтому провести полноценный кариологический анализ на митотических хромосомах (глава V) не всегда возможно. В последние годы для пренатальной диагностики все более широко применяется FISH с хромосомоспецифическими ДНК-зондами на интерфазных ядрах или CGH – сравнительная геномная гибридизация, которые не требуют получения клеток на стадии метафазы (раздел 5.5). Наконец, после 18-ой недели используют кордоцентез – образцы крови плода получают из вены пуповины. Риск осложнений при последнем способе минимален, но прерывание беременности в случае обнаружения серьезной патологии в этот период требует длительной госпитализации и чревато осложнениями
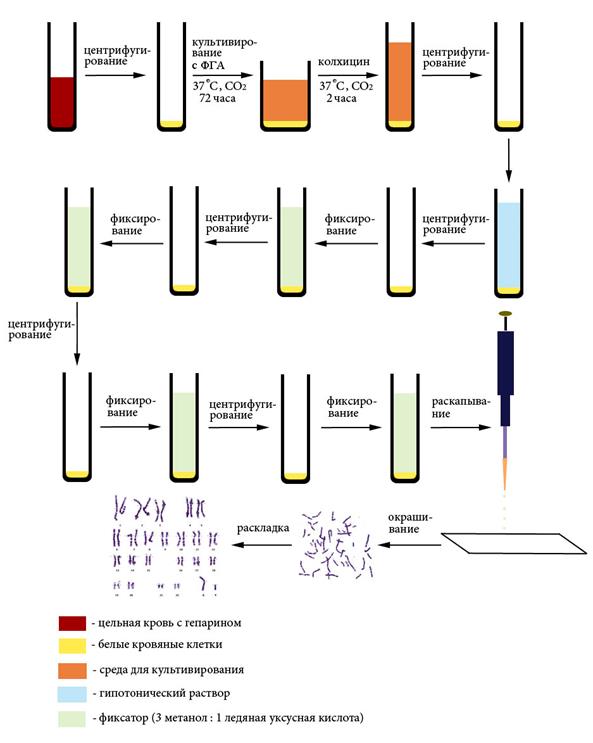
Рисунок X, 1.Приготовление препаратов митотических хромосом из культуры лейкоцитов периферической крови.
Основным методом диагностики хромосомных аномалий после рождения является цитогенетический (кариологический) анализ на метафазных хромосомах. Иногда применяют методы экспресс-диагностики на интерфазных клетках. Например, для быстрого подсчета числа Х-хромосом клетки буккального эпителия окрашивают ацетоорсеином или любым неспецифическим красителям. При кариотипе 46, XX в ядре присутствует относительно крупная плотная глыбка – тельце Барра – инактивированная X-хромосома. У мужчин тельце Барра отсутствует. Нетрудно догадаться, что число телец Барра равно числу X-хромосом за вычетом единицы. Для выявления Y-хромосомы в интерфазе используют окраску АТ-специфическими флуорохромами. При этом крупный гетерохроматиновый блок длинного плеча Y-хромосомы очень ярко флуоресцирует. Число таких блоков соответствует числу Y-хромосом. Для получения препаратов митотических хромосом чаще всего используют культуры лейкоцитов периферической крови (Рисунок X, 2). Методы дифференциального окрашивания хромосом, принципы кариологического анализа на митотических хромосомах и описание основных хромосомных заболеваний представлены в главе VII. В последние годы как отдельную группу хромосомных аномалий выделяют микроцитогенетические синдромы (микроделеции и микродупликации). Для их диагностики используют молекулярно-цитогенетические методы (раздел 5.5).
10.2 Диагностика гетерозиготного носительства и определение генетического риска моногенных заболеваний
Молекулярно-генетическая диагностика проводится прямым методом (если при этом анализируют ген, непосредственно вовлеченный в патологию) или косвенным (при помощи ассоциированных с заболеванием ДНК-маркеров). Основными методами молекулярно-генетической диагностики являются ПЦР и секвенирование (разделы 7.5 и 7.6). Биологическим образцом для выделения ДНК может быть любая ткань. Чаще используют соскоб буккального эпителия (с внутренней стороны щеки), периферическую кровь или волосяные луковицы, потому что их получение наименее травматично. Для диагностики наследственных заболеваний у умерших можно использовать костные останки или фрагменты мумий. Выделение ДНК проводят фенол-хлороформным методом или путем очистки на колонках. Результаты ПЦР обычно анализируют при помощи капиллярного электрофореза (рисунок Рисунок X, 2; раздел 7.5). Молекулярно-генетическая диагностика может проводиться как пренатально, так и в любом возрасте после рождения, так как ДНК не изменяется в онтогенезе.
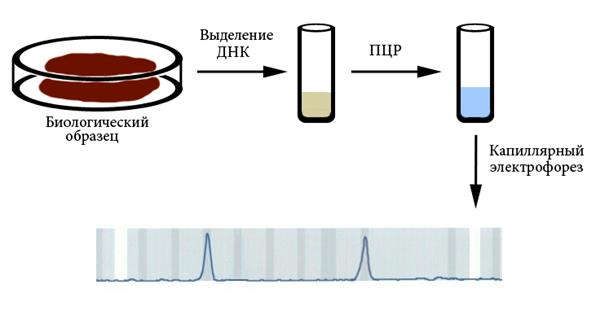
Рисунок X, 2.Схема наиболее типичного способа молекулярно-генетической диагностики.
Расчет генетического риска при моногенных заболеваниях основан на законах Менделя (глава II). Если один из супругов является гомозиготой по аллелю дикого типа (отсутствие заболевания), а генотип второго супруга не известен, то риск рождения больного ребенка соответствует частоте встречаемости данного заболевания в популяции. При полной пенетрантности в семье гетерозигот по аутосомно-рецессивному заболеванию риск рождения больного ребенка – 0,25. При неполной пенетрантности необходимо внести поправку. Например, при пенетрантности 80% у гетерозигот по аутосомно-рецессивному заболеванию риск составит 0,25 x 0,8 = 0,2. В случае аутосомно-доминантных заболеваний с поздней манифестацией вносят дополнительные поправки с учетом возраста пробанда.
Контрольные вопросы и задания к главе X
1. У пациента обнаружено три тельца Барра. Каков его предполагаемый кариотип?
2. Оба супруга – гетерозиготы по мутации гена LCT. Каков риск рождения ребенка с непероносимостью лактозы?
3. Рассчитайте генетический риск рождения мальчика с синдромом Леша-Нихена у гетерозиготной по мутации гена HPRT1 матери и здорового отца.
Дополнительная литература к главе X
Н.П. Бочков. Клиническая генетика // М.: Гэотар-Мед. 2002. – 457 С.
Дата добавления: 2015-07-22; просмотров: 1577;
