Лабораторна робота № 212 ВИЗНАЧЕННЯ СПІВВІДНОШЕННЯ ТЕПЛОЄМНОСТЕЙ ПОВІТРЯ СP/СV МЕТОДОМ КЛЕМАНА–ДЕЗОРМА
Завдання: експериментально визначити співвідношення теплоєм-ностей повітря за сталого тиску і сталого об’єму СP /СV.
Приладдя: установка для визначення співвідношення теплоємностей повітря.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ізопроцеси в ідеальному газі; адіабатичний процес; рівняння Пуассона; внутрішня енергія ідеального газу; теплоємність, питома та молярна теплоємності; теплоємність за сталого тиску і сталого об’єму; рівняння Майєра; ступені вільності молекул; визначення СP /СV через ступені вільності молекул.
Література:
1) § 16.2–16.5, с. 285–304;
2) § 18.6–18.8, c. 68–74;
3) § 45–46, с. 104–146; § 71–72, с. 223–232;
4) § 41, с. 73–75; § 50–51, с.88–90; § 53,55, с. 94–96.

Опис установки. Експериментальна установка (рис. 13) складається зі скляної посудини 1, герметично закритої корком 5. Через корок проходить скляна трубка з двоходовим краном 4. Кран 4 може з’єднувати посудину 1 з атмосферою або ж із помпою 2, якщо кран 3 відкритий. У першому випадку тиск повітря в балоні дорівнює атмосферному, а різниця рівнів рідини у манометрі 6 – нулю. Якщо кран 4 повернути в інше положення і помпою 2 нагнітати повітря в балон, то тиск у ньому збільшиться на Dр = rgh, де r – густина, а h – різниця рівнів рідини в манометрі 6.
Ідея роботи та виведення робочої формули. В цій роботі досліджують процес адіабатичного розширення газу, який описує рівняння Пуассона
PVg = const або P1-g Tg = const , (1)
де g = СP / СV– показник адіабати.
Очевидне таке: якщо зв’язок між параметрами двох станів газу Р і Т відомий, то з (1) можна отримати вираз для розрахункуСP/СV. У цій роботі досліджуваним газом є повітря, яке міститься в балоні. Після нагнітання в балон повітря його рівноважний стан визначатимуть такі параметри: V, Т1 і P1, де V– об’єм балона; Т1– кімнатна температура, а
Р1=Р0+rgh1. (2)
ТутP0 – атмосферний тиск; h1 – різниця рівнів рідини в манометрі.
Переведемо повітря в балоні в інший стан, з’єднавши за допомогою крана 4 об’єм балона на короткий проміжок часу з атмосферою. Внаслідок адіабатичного розширення частина повітря вийде з балона. Тиск у балоні буде дорівнювати P0, а температура знизиться до Т2. Цей процес описує рівняння (1), а саме:
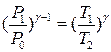 . (3)
. (3)
Після закриття крана 4 повітря в балоні з часом знову нагріється до кімнатної температури Т1, а тиск у балоні
Р2=Р0+rgh2. (4)
Зазначимо, що цей процес є ізохорним, оскільки об’єм повітря в балоні не змінюється, а тому
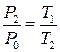 . (5)
. (5)
Параметри T1 і P2 визначають третій стан газу.
Підставимо (5) у (3), отримаємо
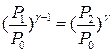 . (6)
. (6)
Прологарифмуємо рівняння (6) і розв’яжемо його щодо g:
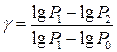 , (7)
, (7)
або, використавши (2) і (4),
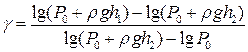 . (8)
. (8)
Розкладемо логарифми в ряд Тейлора і, обмежившись двома першими членами, матимемо
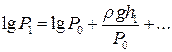 i
i 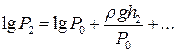
Підставимо отримані вирази в рівняння (8) і отримаємо
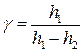 . (9)
. (9)
Формула (9) є робочою формулою цієї лабораторної роботи.
Дата добавления: 2015-07-22; просмотров: 1012;
