Фазові переходи першого і другого роду
Розрізняють фазові переходи першого і другого роду. Фазові переходи першого роду завжди супроводжуються виділенням або поглинанням теплоти, яку називають прихованою теплотою фазового переходу. Прикладами фазових преходів першого роду можуть бути такі процеси, як плавлення, кристалізація, випаровування, конденсація, сублімація, полі-морфні перетворення тощо. Характерним для фазових переходів першого роду є те, що вони відбуваються за сталої температури, тоді як ентропія системи й об’єм фаз змінюються. Сталість температури під час фазового переходу (наприклад, випаровування) можна пояснити тим, що теплота, якої надають тілу, витрачається не на нагрівання, а на роботу з руйнування міжмолекулярних зв’язків. Під час зворотного процесу (конденсації) система виділятиме теплоту за сталої температури.
 Фазові переходи, не пов’язані з виділенням (поглинанням) теплоти і зміною об’єму фаз, називають фазовими переходами другого роду. Під час фазового переходу другого роду ентропія системи залишається сталою, тоді як теплоємність, коефіцієнт об’ємного розширення та ізотермічний коефіцієнт стисливості змінюються стрибкоподібно. До фазових переходів другого роду відносять перетворення феромагнетиків під час нагрівання у парамагнетики, а сегнетоелектриків – у діелектрики; перехід деяких речовин за низьких температур у надпровідний стан та ін. Фазові переходи першого роду кількісно описує рівняння Клапейрона–Клаузіуса, яке пов’язує тиск і температуру двофазової системи, що перебуває в стані термодинамічної рівноваги. Для виведення цього рівняння розглянемо нескінченно малий цикл Карно, який відбувається у двофазовій системі рідина–насичена пара (рис. 6.1).
Фазові переходи, не пов’язані з виділенням (поглинанням) теплоти і зміною об’єму фаз, називають фазовими переходами другого роду. Під час фазового переходу другого роду ентропія системи залишається сталою, тоді як теплоємність, коефіцієнт об’ємного розширення та ізотермічний коефіцієнт стисливості змінюються стрибкоподібно. До фазових переходів другого роду відносять перетворення феромагнетиків під час нагрівання у парамагнетики, а сегнетоелектриків – у діелектрики; перехід деяких речовин за низьких температур у надпровідний стан та ін. Фазові переходи першого роду кількісно описує рівняння Клапейрона–Клаузіуса, яке пов’язує тиск і температуру двофазової системи, що перебуває в стані термодинамічної рівноваги. Для виведення цього рівняння розглянемо нескінченно малий цикл Карно, який відбувається у двофазовій системі рідина–насичена пара (рис. 6.1).
Якщо системі надати кількість теплоти Q1, то її об’єм збільшиться ізотермічно від V1 до V2 (рис. 6.1, процес 1–2), оскільки частина рідини випаровується, щоб підтримувати пару в стані насичення. Тиск насиченої пари за цих умов є сталим. Під час нескінченно малого адіабатного розширення системи (V2»V3) її температура зменшується до Т–dT, а тиск – до р–dр. Під час ізотермічно-ізобарного стискання (3–4) об’єм системи зменшується до V4, частина пари конденсується у рідину, а теплота Q2 переходить до холодильника. Далі адіабатним нескінченно малим стисненням (V4»V1) систему повертають у початковий стан 1. Корисна робота, виконана системою під час циклу Карно,
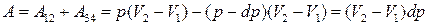 . (6.1)
. (6.1)
Роботою під час адіабатичних процесів 2–3 і 4–1 ми знехтували, оскільки ΔV1 і ΔV2 є нескінченно малими. Коефіцієнт корисної дії такого циклу Карно
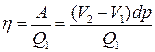 або
або 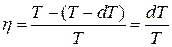 . (6.2)
. (6.2)
Звідси
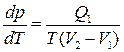 . (6.3)
. (6.3)
Нехай кількість наданої системі теплоти Q1 дорівнює питомій теплоті пароутворення r=q (теплота фазового переходу). Тоді зміна об’єму системи V2–V1 дорівнюватиме різниці питомих об’ємів насиченої пари і рідини за температури Т і тиску р:
V2–V1=v2 – v1. (6.4)
За цих умов рівняння (6.4) зведемо до вигляду
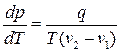 , (6.5)
, (6.5)
де q – питома теплота фазового переходу.
 Це і є рівняння Клапейрона–Клаузіуса, яке визначає залежність температури фазового переходу від тиску. Зазначимо, що рівняння (6.5) справджується для будь-якого фазового переходу першого роду.
Це і є рівняння Клапейрона–Клаузіуса, яке визначає залежність температури фазового переходу від тиску. Зазначимо, що рівняння (6.5) справджується для будь-якого фазового переходу першого роду.
Для однокомпонентних систем, які складаються з хімічно однорідної речовини, поняття фази тотожне поняттю агрегатного стану. Умови існування речовини в одному з трьох агрегатних станів (твердому, рідкому чи газоподібному) визначені тиском і температурою термодинамічної систе-ми. Для зображення фазових переходів використовують діаграму стану (рис. 6.2), на яку в координатах p, V задають залежності між температурою фазового переходу і тиском. На графіку ці залежності показано кривими фазової рівноваги між двома співіснуючими фазами, де АВ – крива сублімації, ВК – крива випаровування, ВС і ВД – криві плавлення. Точка перетину в цих кривих визначає умови одночасного співвідношення всіх трьох фаз речовини – Т3 і р3. Це так звана потрійна точка. Зокрема, для води за нормального атмосферного тиску потрійній точці відповідає температура 273,16 К (0,01оС), це реперна точка для побудови термодинамічної шкали температур. Зазначимо, що криву випаровування ВК завжди позначають скінченним відрізком, який починається у потрійній точці В і закінчується у точці К, яка відповідає критичній температурі Тк. Це пояснюється тим, що за температури Т≥Тк зникає різниця між рідиною і газоподібним станом речовини, отже, немає сенсу говорити про співіснування двох фаз.
 Типовий вигляд фазової діаграми, показаний на рис. 6.2, притаманний лише речовинам, для яких не характерний поліморфізм. За наявності поліморфних перетворень фазові діаг-рамми ускладнені. Наприклад, фазова діаграма сірки, яка може мати дві кристалічні модифікації (ромбічну і моноклінну), містить не одну, а три потрійні точки В1, В2 і В3 (рис. 6.3).
Типовий вигляд фазової діаграми, показаний на рис. 6.2, притаманний лише речовинам, для яких не характерний поліморфізм. За наявності поліморфних перетворень фазові діаг-рамми ускладнені. Наприклад, фазова діаграма сірки, яка може мати дві кристалічні модифікації (ромбічну і моноклінну), містить не одну, а три потрійні точки В1, В2 і В3 (рис. 6.3).
Нахил кривих фазової рівноваги визначають на підставі рівняння Клапейрона-Клаузіуса за співвідношенням між V2 i V1. Оскільки q і T є додатними, то за умови V2 >V1 dP/dT>0, а за умови V2<V1, dP/dT<0. Під час сублімації і випаровування об’єм газової фази завжди більший, отже, dP/dT>0 і відповідні криві мають додатний нахил (див. рис. 6.3, криві АВ і ВК). Під час плавлення для більшості речовин об’єм рідкої фази є більшим, ніж об’єм твердої, отже, криві плавлення таких речовин також матимуть додатний нахил (крива ВС). Водночас для деяких речовин (вода, вісмут, германій, чавун та ін.) V2<V1, тому їхні криві плавлення мають від’ємний нахил. Температура плавлення таких речовин знижується з підвищенням тиску (див. рис. 6.2, крива ВД).
За діаграмою стану можна визначити у якому стані перебуватиме речовина за заданих р і Т та які фазові переходи будуть характерними для неї в тому чи іншому процесі. Наприклад, точці 1 відповідає твердий стан, а точці 3 – газоподібний. Під час ізобарного нагрівання (процес 1–2–3) за температури Та речовина плавитиметься. Після повного розплавлення відбуватиметься нагрівання рідини від температури Та до Тb. За температури Тb рідина почне випаровуватись і перейде у газоподібний стан.
 Розглянемо залежність температури однорідної кристалічної речовини під час її нагрівання за сталого зовнішнього тиску. Якщо речовина перебуває у твердому стані, то кількість теплоти, яка надходить до нього зовні, витрачається на збільшення енергії коливального руху його атомів, що супроводжується підви-щенням температури (рис. 6.4, ділянка ОА). За температури Тпл речовина починає плавитись та існує одночасно в двох фазах до моменту часу t2. Теплота, яку отримає тіло під час плавлення, витрачається на роботу з руйнування кристалічної ґратки (прихована теплота плавлення), тому її температура не змінюється (ділянка АВ). У точці В речовина перебуває у рідкому стані, а подальше отримання теплоти спричинює нагрівання рідини (ділянка ВС). За температури Ткип розпочинається кипіння рідини (ділянка СД), яке триватиме за сталої температури до повного перетворення рідкої фази в газоподібну (точка Д). Ділянка ДЕ відповідає нагріванню газоподібної фази.
Розглянемо залежність температури однорідної кристалічної речовини під час її нагрівання за сталого зовнішнього тиску. Якщо речовина перебуває у твердому стані, то кількість теплоти, яка надходить до нього зовні, витрачається на збільшення енергії коливального руху його атомів, що супроводжується підви-щенням температури (рис. 6.4, ділянка ОА). За температури Тпл речовина починає плавитись та існує одночасно в двох фазах до моменту часу t2. Теплота, яку отримає тіло під час плавлення, витрачається на роботу з руйнування кристалічної ґратки (прихована теплота плавлення), тому її температура не змінюється (ділянка АВ). У точці В речовина перебуває у рідкому стані, а подальше отримання теплоти спричинює нагрівання рідини (ділянка ВС). За температури Ткип розпочинається кипіння рідини (ділянка СД), яке триватиме за сталої температури до повного перетворення рідкої фази в газоподібну (точка Д). Ділянка ДЕ відповідає нагріванню газоподібної фази.
Якщо ж речовина спочатку перебуває в газоподібному стані, і від неї забирають теплоту, то простежуватимемо два протилежні фазові переходи першого роду – за Т=Ткип газова фаза перейде в рідину (конденсація), а за Т=Тпл рідка фаза перетвориться у тверду (кристалізація). Для обох фазових переходів характерне виділення прихованої теплоти за сталої температури. Зазначимо, що, відповідно до рівняння (6.5), температура фазового переходу залежить від тиску.
Дата добавления: 2015-07-22; просмотров: 1769;
