Общие сведения. Катализомназывается изменение скорости реакции под действием веществ, не входящих в суммарное уравнение этой реакции.
Катализомназывается изменение скорости реакции под действием веществ, не входящих в суммарное уравнение этой реакции.
Не входящие в суммарное уравнение вещества могут как ускорять реакцию, так и замедлять ее. В первом случае они называются катализаторами, а во втором - ингибиторами.
Катализаторы, влияющие на скорость превращения веществ, не могут изменять константу равновесия. Если бы константа равновесия зависела от присутствия или отсутствия катализатора в реакционной среде, то вводя катализатор в систему или удаляя его из нее, можно было бы добиваться процессов, самопроизвольно приводящих каждый раз к новому положению равновесия. Эти процессы могут приводить к производству работы системой, превращая ее в своеобразный вечный двигатель.
Так как катализатор не смещает положение равновесия, а только ускоряет его наступление, то он в равной мере ускоряет прямую и обратную реакцию.
Действие катализатора на превращаемые вещества предполагает возникновение промежуточных соединений с энергией активации, меньшей, чем энергия образования активного комплекса без катализатора.
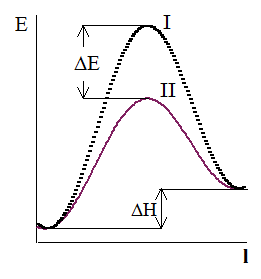 Рис. 16 - 1. Упрощенная схема энергетического профиля при образовании активного комплекса без катализатора (I) и с катализатором (II) (DE ‑ потенциальная энергия, DH ‑ энтальпия реакции).
Рис. 16 - 1. Упрощенная схема энергетического профиля при образовании активного комплекса без катализатора (I) и с катализатором (II) (DE ‑ потенциальная энергия, DH ‑ энтальпия реакции).
|
На рис. 16 - 1 приведены упрощенные схемы образования активного комплекса только из исходных веществ и продуктов реакции, а также активного комплекса с катализатором. Разность энергии веществ в конечном и исходном состоянии остается одной и той же. Следовательно, тепловой эффект реакции также остается постоянным.
Важнейшими характеристиками катализаторов являются специфичность (или избирательность) и активность.
Под специфичностью катализатораподразумевается его способность ускорять реакцию, приводящую к выходу строго определенного продукта.
Активность катализатораможно оценить по нескольким показателям. Один из них - снижение энергии активации при действии катализатора. Другим показателем активности катализатора является отношение скорости реакции при введении единицы его массы (г, мг) в единичный объем (л, см3 и др.) среды к скорости реакции без катализатора.
Классификация катализа проводится по агрегатному состоянию катализатора и веществ, превращение которых он ускоряет.
Если катализатор является твердым веществом, а превращаемые вещества находятся в газовой фазе или жидкости, то такой катализ называется гетерогенным. В тех случаях, когда катализатор и вещества, на которые он воздействует, находятся в одной фазе, то такой катализ является гомогенным.
Примером гомогенного катализа может служить разложение в газовой фазе альдегидов в присутствии паров йода по схеме:
R-CHO ¾®RH + CO.
Известно также, что в газовых фазах некоторые реакции окисления ускоряются при небольших добавках паров воды, а реакции термического разложения органических соединений - при введении очень малого объема кислорода.
Предполагается, что действие этих веществ связано с образованием свободных радикалов. Чем больше концентрация катализатора, тем больше свободных радикалов может образовываться в данной системе и тем выше скорость реакции. Однако многостадийный характер процесса превращения исходных веществ в продукты может усложнить зависимость скорости реакции от концентрации катализатора в газовой фазе. Известны реакции, у которых начальная скорость возрастает прямо пропорционально концентрации катализатора. У других эта зависимость характеризуется дробным порядком. В общем случае для реакции превращения вещества в продукты можно записать:
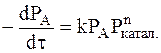 , (16 - 1)
, (16 - 1)
где PA - давление вещества А, Pкатал. - давление катализатора, n - порядок по катализатору.
Важнейшие случаи гомогенного катализа в растворах рассматриваются ниже.
Дата добавления: 2015-07-22; просмотров: 718;
