Часть 3. Химическая кинетика и катализ
В предыдущих частях в основном рассматривались системы, находящиеся в статических или близких к ним условиях. Поэтому время как величина, влияющая на состояние системы, отсутствует во всех соотношениях.
Химическая кинетика является тем разделом физической химии, в котором рассматриваются качественные и количественные изменения в системах с течением времени.
Глава 9. Формальная кинетика
Основные понятия
В химической кинетике основным понятием является скорость химического превращения, под которой понимают производную количества данного вещества ni по времени:
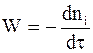 . (9 - 1)
. (9 - 1)
Скорость реакции всегда является положительной величиной. Знак минус в выражении (9 - 1) означает, что количество вещества в результате реакции уменьшается.
Скорость химического превращения в системе, имеющей объем V, зависит от частоты столкновения молекул друг с другом в единицу времени. Вероятность столкновения молекул за определенный промежуток времени тем выше, чем больше концентрации реагирующих веществ. В связи с этим удобнее пользоваться понятием скорости реакцииданного вещества vi, равной скорости превращения его в единице объема. В 1867 г. Гульдберг и Вааге сформулировали принцип, определяющий зависимость скорости реакции от концентраций реагирующих веществ в гомогенной системе. В соответствии с ним для реакции, протекающей в направлении, указанном стрелкой,
n1 A1+ n2 A2 + ni Ai ... ® продукты реакции,
с непосредственным получением продуктов, то есть без образования промежуточных соединений, должно быть применимо уравнение:
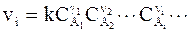 , (9 - 2)
, (9 - 2)
где 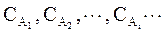 - концентрации исходных веществ, n1, n2, ¼, ni,¼ - стехиометрические коэффициенты, k - константа скорости химической реакции.
- концентрации исходных веществ, n1, n2, ¼, ni,¼ - стехиометрические коэффициенты, k - константа скорости химической реакции.
Уравнение (9 - 2) является записью основного постулата формальной кинетики. Иногда его называют кинетической формой закона действия масс.
Из определений, используемых в соотношениях (9 - 1) и (9 ‑ 2), следует:
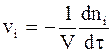 . (9 - 3)
. (9 - 3)
Для постоянного объема основной постулат формальной кинетики приобретает вид:
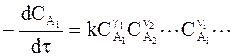 . (9 - 4)
. (9 - 4)
Если концентрации всех веществ взять одинаковыми, то есть при условии, что 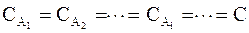 , выражение (9 ‑ 4) примет следующий вид:
, выражение (9 ‑ 4) примет следующий вид:
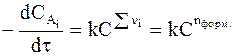 . (9 - 5)
. (9 - 5)
Сумма показателей степени Sni = nформ. называется формальным порядком реакции.
Если концентрация вещества i во много раз меньше концентраций остальных веществ, то относительные изменения концентраций последних в ходе реакции окажутся ничтожно малыми. При выполнении этого условия все концентрации, кроме концентрации вещества i, можно, как постоянные величины, включить в общую константу и уравнение (9 - 5) преобразуется в следующее:
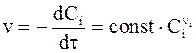 . (9 - 6)
. (9 - 6)
Указанный прием выделения в уравнении в качестве переменной концентрации только одного вещества называется методом изолирования, а показатель степени только у одного вещества называется порядком реакции по веществу.
Для некоторых реакций формальный порядок может оказаться очень большим. Например, для реакции
5Na2S + 8KMnO4 + 12H2SO4 ¾® 5Na2SO4 + 8MnSO4 + 4K2SO4 + 12H2O
формальный порядок реакции должен быть равен 25. Это означает, что повышение концентрации в два раза должно было бы приводить к повышению скорости в 225 » 30×106 раз.
В действительности столь огромное повышение скорости не наблюдается (обычное возрастание скорости при указанном повышении концентрации может составить от 2 до 4 раз и никогда не превышает 8).
Экспериментально устанавливаемая зависимость скорости реакции от концентрации обычно выражается (при равенстве концентраций всех веществ) уравнением:
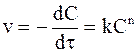 . (9 - 7)
. (9 - 7)
Показатель степени в уравнении (9 - 7) имеет несколько названий: реальный порядок реакции, экспериментально определяемый порядок реакции, действительный порядок реакции. В дальнейшем его будем называть просто порядком реакции.
Установлено, что
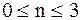 .
.
Реакции, для которых n = 0, называются реакциями нулевого порядка. Реакции с n = 1, n = 2 и n = 3 называются соответственно реакциями первого, второгои третьего порядка. В ходе экспериментов по определению порядка реакции может быть установлено, что показатель степени n является дробным числом. В этих случаях говорят о дробном порядке реакции.
Расхождение между действительным порядком реакции и формальным порядком реакции объясняется следующим образом.
Реально протекающая химическая реакция проходит через несколько стадий, причем скорости на разных стадиях могут отличаться во много раз. Еще один постулат химической кинетики утверждает:
Скорость реакции в целом определяется скоростью самой медленной стадии.
В свою очередь скорость любой стадии определяется числом одновременно участвующих в превращении частиц. Например, стадия может происходить при столкновении двух молекул или трех молекул. Существуют стадии, на которых частица превращается в новую частицу без столкновения с иными. Число частиц, одновременно превращающихся на данной стадии реакции, называется молекулярностьюэтой стадии. Превращение одной частицы без столкновения с другими называется мономолекулярным превращением. Стадия, на которой сталкиваются и одновременно превращаются две частицы, называется бимолекулярным превращением. Возможно тримолекулярное превращение. Превращение с одновременным участием более трех частиц невозможно по пространственному их расположению. Если имеется какая-либо одна стадия, скорость которой во много раз меньше скорости всех остальных стадий, то молекулярность этой стадии совпадает с порядком всей реакции.
Очень часто понятия молекулярность и порядок смешивают. Нередко можно встретить выражения: мономолекулярная или бимолекулярная реакция. Хотя более точными выражениями являются: реакция первого или второго порядка. Перенесение понятий для реакций с целочисленным порядком не является грубой ошибкой.
Отметим, что изучение последовательности стадий химической реакции является чрезвычайно интересной и важной задачей, так как позволяет находить способы управления химическим процессом (каталитическое ускорение, ингибирование - замедление определенных стадий реакции, повышение выхода какого-либо вещества и др.). Последовательность стадий химического превращения называется механизмом химической реакции.
В заключение рассмотрим еще один постулат химической кинетики, который называется постулатом (или принципом) независимого протекания реакций. Его можно сформулировать следующим образом:
Скорость реакции, протекающей в данном направлении, не зависит от скоростей реакций, протекающих в других направлениях, и при прочих равных условиях зависит только от мгновенного значения концентраций.
Поясним постулат независимого протекания реакций некоторыми примерами.
Пусть одновременно протекают две реакции:
A + B ® C + D и C + D ® A + B. Скорость каждой из них не зависит от скорости другой реакции, а определяется только действующими концентрациями веществ A, B, C, D.
Если из одних и тех же веществ A и B одновременно по реакциям A + B ® C и A + B ® D образуются вещества C и D, то скорости этих реакций в данный момент времени не зависят друг от друга.
Дата добавления: 2015-07-22; просмотров: 1017;
