Окислительно-восстановительные электроды
На электродах всех видов протекают реакции окисления или восстановления. Однако если реакция протекает на поверхности инертного материала и при этом не выделяется металл или газообразное вещество, то такие электроды принято называть окислительно-восстановительными, или редокс-электродами. Различают два вида окислительно-восстановительных электродов.
Простые окислительно-восстановительные электроды отличаются тем, что не сопровождающееся образованием металла или газообразных веществ изменение степени окисления элемента на поверхности инертного материала происходит без участия ионов или молекул других веществ.
Простые редокс-электроды характеризуются электродной реакцией, которую можно представить в общей форме:
Mz+ + ye = M(z−y)+,
условной записью
Mz+, M(z−y)+ ÷ Pt
и выражением для электродного потенциала
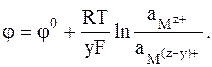 (2 - 5)
(2 - 5)
В качестве примера простого редокс-электрода можно привести электрод, на котором происходит восстановление ионов Fe3+ до Fe2+:
Fe3+ + e = Fe2+,
Fe3+, Fe2+÷ Pt,

Кроме приведенного электрода к числу простых редокс-электродов относятся цериевый электрод Ce4+,Ce3+/Pt, на котором протекает реакция:
Ce4+ + e = Ce3+,
таллиевый Tl3+,Tl+/Pt, ванадиевый V3+, V2+/Pt электроды и др.
Соотношение между активностями ионов с разной степенью окисления в простом редокс-электроде и, следовательно, электродный потенциал его зависят от окислительных свойств среды. С этой целью они могут использоваться в аналитической химии и биохимических исследованиях.
Еще одно применение простых редокс-электродов связано с расчетом потенциала некоторых гипотетических электродов.
Как правило, электрод, содержащий ионы в высшей степени окисления в контакте с металлом, например, Fe3+/Fe, неустойчив. Для расчета потенциала такого гипотетического электрода можно воспользоваться следующим приемом.
Найдем стандартный потенциал устойчивого электрода 1-го рода, в котором ионы с низшей степенью окисления металла находятся в контакте с металлом:
M(z−y)+ + (z-y)e = M, 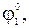
и стандартный электродный потенциал устойчивого простого редокс-электрода
Mz+ + ye = M(z-y)+, 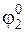 .
.
Ионы с высшей степенью окисления можно восстановить до металла, проведя последовательно процессы в гальванических элементах, первый из которых состоит из стандартного электрода сравнения и простого редокс-электрода и работа в котором равна
W’1= 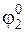 ×yF,
×yF,
а второй состоит из стандартного электрода и электрода 1-го рода и в котором совершается работа, равная
W’2 = 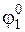 ×(z-y)F.
×(z-y)F.
Вся работа по восстановлению ионов с высшей степенью окисления до металла равна
W’ = W’1 + W’2 .
Если бы была возможна реакция прямого восстановления ионов в высшей степени окисления
Mz+ + ze = M, 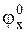 ,
,
то работа по восстановлению ионов оказалась бы равной
W’x = 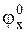 ×zF.
×zF.
Так как при постоянном давлении и постоянной температуре полезная работа квазистатического процесса не зависит от пути (она определяется приращением энергии Гиббса), то из равенства работ
W’x = W’ следует
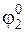 ×yF +
×yF + 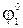 ×(z−y)F =
×(z−y)F = 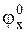 ×zF.
×zF.
Таким образом, стандартный потенциал гипотетического электрода можно вычислить по формуле:
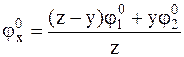 , (2 - 6)
, (2 - 6)
которая называется формулой Лютера.
Сложные окислительно-восстановительные электроды. Отличительной особенностью этих электродов является то, что в реакции окисления или восстановления принимают участие другие ионы и молекулы.
Приведем в качестве примера сложного редокс-электрода кислотный перманганатный электрод:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O,
MnO4-, Mn2+, H+÷ Pt,
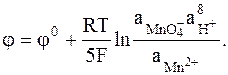
Еще одним примером сложного редокс-электрода может служить гипойодиттно-йодидный электрод:
IO- + H2O + 2e = I- + 2OH−,
IO-,I-, OH-÷ Pt,
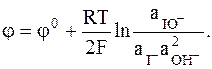
Существуют разнообразные варианты сложных редокс-электродов, которые невозможно выразить единой формой записи. Характерно, что электродный потенциал сложных окислительно-восстановительных электродов зависит от водородного показателя среды. Эта особенность использована для измерения рН в специальном электроде - хингидронном электроде.
Хингидронный электрод представляет собой платиновую проволоку, погружаемую в исследуемую среду, в которую добавлено небольшое количество кристаллов хингидрона- эквимолекулярной смеси хинона С6Н4О2 и гидрохинона С6Н4(ОН)2.Хингидрон трудно растворяется в воде. Поэтому активность кристаллов хингидрона можно считать равной 1. На этом электроде происходит восстановление хинона до гидрохинона:
С6Н4О2 + 2Н+ +2е = С6Н4(ОН)2.
Условно электрод можно записать следующим образом:
Н+÷ С6Н4О2,С6Н4(ОН)2, Pt.
Электродный потенциал хингидронного электрода зависит от рН среды:
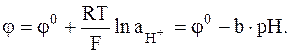
Хингидронный электрод работает только в кислых и нейтральных средах, так как в щелочных средах происходит образование солей гидрохинона, которые хорошо растворимы в воде.
Дата добавления: 2015-07-22; просмотров: 4858;
