Электроды 2-го рода
Электроды 2-го рода содержат металл и труднорастворимое соединение этого металла, контактирующие с раствором, содержащим анионы, входящие в состав труднорастворимого соединения.
В зависимости от типа труднорастворимого соединения металла различают металлогалогенидные электроды, содержащие труднорастворимые галогениды металлов, металлосульфатные, содержащие труднорастворимые сульфаты металлов, и др.
Общая запись электродной реакции для электродов 2-го рода такова:
MxAz +xze = xM + zAx-. (а)
Приведенная выше запись результирующей электродной реакции соответствует двум ее основным стадиям:
· растворению труднорастворимой соли
MxAz = xMz+ + zAx-,
· восстановлению ионов металла на катоде
xMz+ + xze = M.
Таким образом, по механизму катодного процесса электроды 2-го рода принципиально не отличаются от электродов 1-го рода.
Отвечающая суммарной реакции (а) условная запись электрода 2-го рода имеет следующий вид:
Ax−ôMz+ , M .
Этой же реакции соответствует выражение для электродного потенциала:
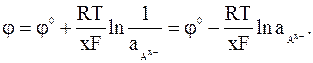 (2 - 2)
(2 - 2)
Потенциал электродов 2-го рода зависит от активности анионов. Поэтому их часто называют электродами, обратимыми по анионам.
Электроды 2-го рода широко применяются при проведении электрохимических измерений. Кроме того, данные по их стандартным электродным потенциалам используются для расчета произведения растворимости PS труднорастворимых солей. С этой целью сравнивают стандартный потенциал электрода 2-го рода 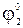 со стандартным потенциалом электрода 1-го рода с соответствующим металлом
со стандартным потенциалом электрода 1-го рода с соответствующим металлом 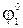 . Так как в системе, содержащей труднорастворимую соль MxAz, устанавливается равновесие
. Так как в системе, содержащей труднорастворимую соль MxAz, устанавливается равновесие
MxAz = xMz+ + zAx-,
характеризуемое константой равновесия
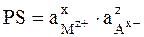 ,
,
то стандартным условиям для электрода 2-го рода ( 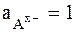 ) отвечает активность ионов металла, равная
) отвечает активность ионов металла, равная 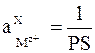 . Таким образом, выполняется условие:
. Таким образом, выполняется условие:
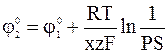 ,
,
из которого следует:
 . (2 - 3)
. (2 - 3)
Изучение наиболее известных электродов 2-го рода начнем с класса металлогалогенидных, из которых наиболее распространена группа металлохлоридных электродов.
Каломельный электрод. Его название дано по труднорастворимому хлориду ртути (I) - каломели Hg2Cl2.
Каломельный электрод характеризуют:
· электродная реакция:
Hg2Cl2 + 2e = 2Hg + 2Cl-,
· условная запись:
Cl-ôHg2Cl2, Hg,
· выражение для электродного потенциала:
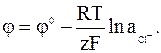
Для изготовления каломельного электрода каломель перетирают с раствором хлорида калия и несколькими каплями ртути до получения однородной пасты, которую наслаивают на поверхность ртути, помещаемой в стеклянную емкость. Сверху на пасту наслаивают раствор хлорида калия. Металлический контакт осуществляют платиновой проволокой, которую впаивают в стекло (платина и лабораторное стекло имеют близкие значения термического коэффициента расширения).
Каломельный электрод отличается прекрасной воспроизводимостью электродного потенциала и очень высокой устойчивостью. Известно, что при хранении свыше 25 лет каломельного электрода не было замечено никакого изменения его электродного потенциала. В связи с этим он широко применялся в качестве практического электрода сравнения. Было предложено использовать следующие типы каломельного электрода:
· децинормальный каломельный электрод, заполняемый 0,1 н. раствором KCl (электродный потенциал такого электрода по отношению к стандартному электроду сравнения при 25°С равен 0,3365 В),
· нормальный каломельный электрод, заполняемый 1 н. раствором KCl (его электродный потенциал по отношению к стандартному электроду сравнения при 25°С равен 0,2828 В),
· насыщенный каломельный электрод, заполняемый насыщенным раствором KCl (потенциал при 25°С равен 0,2438 В).
Наиболее употребительным является насыщенный каломельный электрод. Однако по сравнению с другими типами каломельных электродов у него наибольшая зависимость электродного потенциала от температуры.
Трудности миниатюризации каломельного электрода и работа с ртутью привели к тому, что он повсеместно заменялся серебряногалогенидными электродами.
Серебрянохлоридный электрод является наиболее распространенным представителем группы серебряногалогенидных электродов.
Приводим электродную реакцию, условную запись и выражение для электродного потенциала серебрянохлоридного электрода:
AgCl + e = Ag + Cl-,
Cl−ôAgCl, Ag,
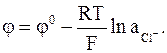
Серебрянохлоридный электрод подобно каломельному электроду имеет хорошую воспроизводимость и устойчивость электродного потенциала. Он широко применяется в качестве практического электрода сравнения (иногда такие электроды называют вспомогательными) не только в водных средах, но и в водных растворах спиртов, кетонов и эфиров.
Для получения серебрянохлоридного электрода тонкую серебряную проволоку покрывают слоем хлорида серебра. С этой целью ее погружают в водный раствор, содержащий хлорид-ионы, и пропускают электрический ток, используя серебряную проволоку в качестве анода. Погруженная в раствор KCl серебряная проволока с электролитическим покрытием AgCl представляет собой готовый электрод сравнения.
Миниатюрные серебрянохлоридные электроды используются в физиологических и биохимических исследованиях.
Ртутносульфатный электродявляется представителем группы металлосульфатных электродов с наиболее устойчивым электродным потенциалом и наиболее высокой воспроизводимостью.
Характеристики этого электрода приводятся ниже:
Hg2SO4 + 2e = 2Hg + SO42-,
SO42-ôHg2SO4, Hg,
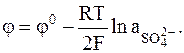
Металлооксидные электроды. В этих электродах анионом, содержащимся в водной среде, служит гидроксид-ион. Частную реакцию на этих электродах можно представить как двухстадийный процесс:
M2Oz + zH2O + 2ze = [2M(OH)z + 2ze]= 2M + 2zOH-.
Электродной реакции соответствует следующая форма условной записи электрода:
OH-ôM2Oz, M.
Выражение для электродного потенциала металлооксидного электрода имеет следующий вид:
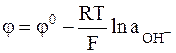 . (2 - 4)
. (2 - 4)
Оно может быть преобразовано с использованием ионного произведения воды
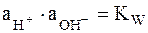
следующим образом:
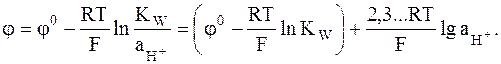
Обозначив
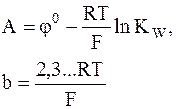

и принимая во внимание, что десятичный логарифм активности водородных ионов представляет собой водородный показатель среды pH, получим
j = A - b×pH.
Входящий в уравнение коэффициент b называется электрохимическим коэффициентом. При 25°С он равен 0,059157 В.
Линейная зависимость между водородным показателем среды и потенциалом металлооксидного электрода предполагает его применение для измерений рН. Такая возможность действительно существует. Однако в кислой среде происходит растворение оксидов и электрод перестает функционировать как рН-метрический.
Примерами металлооксидных электродов могут служить ртутнооксидный и сурьмянооксидный электроды.
Ртутнооксидный электрод характеризуется следующим:
HgO + H2O + 2e = Hg + 2OH-,
OH- ÷ HgO, Hg,
а сурьмянооксидный электрод может быть описан электродной реакцией и условной записью в таком виде:
Sb2O3 + 3H2O + 6e = 2Sb + 6OH-,
OH- ÷ Sb2O3, Sb.
Для изготовления сурьмянооксидного электрода достаточно заполнить стеклянную трубку расплавленной сурьмой и окислить выступающую поверхность сурьмы нагреванием на воздухе.
Электроды на основе металлических сплавов и растворов. Они представляют собой разновидность электродов 1-го и 2-го рода, в которых вместо чистого металла в кристаллической форме используются металлические сплавы или растворы. Многие металлы хорошо растворяются в ртути с образованием амальгамы. В качестве примера амальгамного электрода можно привести кадмиевый амальгамный электрод:
Cd2+ + 2e = Cd (Hg),
Cd2+÷ Cd (Hg),
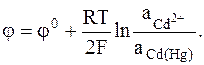
Обращаем внимание на то, что потенциал металла входит в выражение для электродного потенциала, так как в отличие от обычных электродов 1-го и 2-го рода металл не находится в стандартном состоянии.
Дата добавления: 2015-07-22; просмотров: 2673;
