Ионоселективные электроды
Электроды этого типа содержат мембрану, обладающую ионообменными свойствами. Твердая мембрана может быть изготовлена из однородного материала или из частиц ионообменного вещества в твердом связующем, чаще всего в пластической массе. На границе мембраны с раствором могут протекать процессы:
Mz+(раствор) = Mz+(мембрана)
или
Аz+(раствор) = Ax−(мембрана),
где Mz+(раствор) или Аz+(раствор) – катионы или анионы, содержащиеся в растворе, Mz+(мембрана) или Ax−(мембрана) - те же ионы, содержащиеся в мембранах.
Равновесному отношению активностей в растворе и мембране отвечает скачок потенциала. Так как скачок потенциала зависит от определенного сорта ионов, то поверхность мембран рассматривается подобно электроду, обладающему избирательными свойствами по отношению к ионам, и называется ионоселективным электродом.
В частности, потенциал поверхности, зависящий от активности катионов Mz+, можно выразить следующим образом:
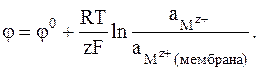 (2 - 8)
(2 - 8)
Самым распространенным ионоселективным электродом является стеклянный электрод, к изучению которого мы приступаем.
Стеклянный электрод представляет собой стеклянную мембрану, разделяющую два раствора, в одном из которых поддерживается постоянной концентрация водородных ионов, а в другом растворе необходимо определить водородный показатель. Потенциал на границе раствор – стеклянная поверхность, на которой протекает процесс:
H+ = H+(ст),
где H+ и H+(ст) означают ионы водорода в растворе и в стекле, может быть выражен формулой:
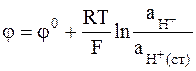 .
.
Способ нахождения отношения активностей ионов водорода в растворе и стекле был предложен Б. П. Никольским на основе представлений об ионном обмене.
Электродное стекло содержит ионы щелочного металла M+, которые могут замещаться ионами водорода. Ионному обмену
M+(ст) +H+ = M+ + H+(ст)
отвечает константа равновесия
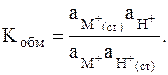
Предполагается, что замещаться могут ионы во всех доступных местах данной мембраны и число замещаемых мест всегда остается постоянным:
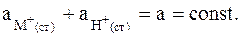
Из двух последних равенств следует
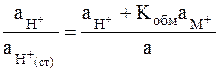
и
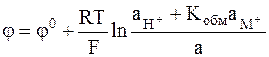 . (2 - 9)
. (2 - 9)
Если константа ионного обмена очень мала, что обеспечивается подбором состава стекла, то выполняется условие: 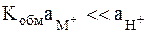 . Для такого образца стекла выражение для электродного потенциала приобретает вид:
. Для такого образца стекла выражение для электродного потенциала приобретает вид:
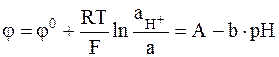 ,
,
где 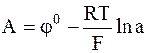 .
.
Для проведения рН-метрических измерений стеклянный электрод из натриевого стекла (содержит SiO2, Na2O и CaO) выдувают из трубки в виде шарика с очень тонкой стенкой (около 0,1 мм). Шарик и частично трубку заполняют внутренним раствором, который часто представляет собой 0,1 М раствор HCl. Во внутренний раствор погружают серебряную проволоку, покрытую AgCl, и трубку тщательно герметизируют, обеспечивая постоянство состава внутреннего раствора. Затем стеклянный электрод погружают в испытуемый раствор, который через солевой мостик контактирует с серебрянохлоридным электродом. Образуется цепь:
Ag, AgClô Cl−, H+ ô стекло ô H+x ôô Cl− ô AgCl, Ag
· внутренний испытуемый ·
(1) раствор раствор (2)
j1 j2 j3 j4
Скачки потенциала в цепи на границах внутреннего электрода сравнения и внутреннего раствора j1, внутреннего раствораôстекло j2, во внешнем электроде сравнения j4 остаются постоянными. Поэтому ЭДС, равная разности потенциалов между точками (2) и (1), должна определяться только активностью ионов водорода H+x испытуемого раствора.
Диапазон значений рН, измеряемых стеклянным электродом, очень велик (приблизительно от 0 до 13 единиц). На стеклянный электрод не действуют соли тяжелых металлов. Он очень удобен для измерений рН в непрозрачных и окрашенных средах.
Стеклянный электрод повсеместно используется в аналитической химии, в промышленности и в биологических исследованиях. Для медицинских целей выпускаются миниатюрные конструкции стеклянного электрода, который можно вводить в вену или артерию для прямых измерений водородного показателя крови.
Стеклянный электрод может быть использован для определения активности ионов щелочных металлов, Ag+, Tl+, NH4+ и некоторых органических катионов. Для этого в стекольную массу вводят оксиды алюминия, бора и др.
Катионная функция (для ионов металлов ее называют металлической функцией) стеклянного электрода объясняется увеличением константы Кобм. В этом случае может быть достигнуто соотношение 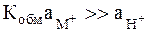 и выражение для электродного потенциала примет следующий вид:
и выражение для электродного потенциала примет следующий вид:
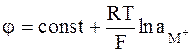 .
.
Избирательность ионоселективных электродов достигает больших величин. Например, содержащий Al2O3 стеклянный электрод позволяет определять активность ионов натрия при 1000-кратном избытке ионов калия.
Мембраны из полимеров и частиц труднорастворимых солей металлов используются для определения в растворах анионов, входящих в состав соли.
Монокристаллы LaF3 были использованы для изготовления лантанфторидных электродов, позволяющих определять содержание фторид-ионов в различных средах, включая слюну.
Дата добавления: 2015-07-22; просмотров: 1493;
