Классическая теория электролитической диссоциации
Идея о возможности распада нейтральных молекул на ионы была высказана Т. Гротгусом в 1805 – 1818 гг. для объяснения электролиза. М.Фарадей предполагал, что молекулы, растворы которых проводят электрический ток, распадаются на ионы под действием внешнего электрического поля, и назвал эти вещества электролитами (распадающиеся под действием электричества).
В 1887 г. С.Аррениус для объяснения коллигативных свойств растворов электролитов и каталитического действия кислот и оснований предложил теорию электролитической диссоциации, согласно которой распад молекул на ионы происходит без действия внешней разности потенциалов.
По теории электролитической диссоциации происходит полный или частичный распад нейтральных молекул на заряженные частицы - ионы. Для простоты будем называть электролиты, полностью диссоциирующие в растворах, сильными электролитами, а электролиты, частично диссоциирующие в растворе, слабыми электролитами(крайне немногочисленную группу, обычно называемую средними электролитами, будем рассматривать вместе со слабыми электролитами). Полнота диссоциации веществ на ионы характеризуется степенью диссоциацииa, равной отношению числа молекул, распадающихся на ионы, к их общему числу в растворе. Доля непродиссоциированных молекул равна (1 - a), а концентрация вещества в молекулярной форме CM равна
CM = (1 - a) C0,
где C0 - общая концентрация (в ионной и молекулярной форме) вещества.
Для сильных электролитов, к которым относятся соли, сильные кислоты и щелочи, a = 1.
В растворах слабых электролитов устанавливается равновесие типа CatxAnz = xCatz+ + zAnx−,
где CatxAnz - молекулы электролита, Catz+ - катионы, Anx− ‑ анионы.
Классификация электролитов проводится также в зависимости от величин зарядов ионов. По этой классификации первым указывается заряд катиона, а затем через горизонтальную черту заряд аниона (иногда вместо черты используют двоеточие). Приведем примеры таких обозначений:
z = 1; x = 1; 1–1 электролит; n = 2, NaCl;
z = 2; x = 1; 2–1 электролит; n = 3, CaCl2;
z = 1; x = 2; 1–2 электролит; n = 3, Na2SO4;
z = 2; x = 2; 2–2 электролит; n = 2, MgSO4;
z = 3; x = 1; 3–1 электролит; n = 4, AlCl3;
и т.д.
В основу еще одной классификации электролитов положена сумма ионов n, образующихся при диссоциации молекулы. Если при диссоциации из одной молекулы образуются только два иона, то электролит называется бинарным. Например, 1–1 электролит и 2–2 электролит являются бинарными. Из 1–2 электролита и 2–1 электролита образуются три иона. Такие электролиты называются тернарными. Электролиты, образующиеся при диссоциации четырех ионов, называются кватернарными.
I. Теория электролитической диссоциации предполагает, что ионы в растворе проявляют себя как независимые частицы, подобные молекулам, что позволяет при известной степени диссоциации рассчитать общее число частиц растворенного вещества, включая молекулы и ионы. Например, для сильного бинарного электролита молярная концентрация всех частиц должна быть в два раза больше молярной концентрации вещества. Для слабого бинарного электролита со степенью диссоциации a концентрация частиц в растворе составит:
C = 2aC0 + (1-a)C0 = (1 + a)C0, (3 - 1)
где С0 - молярная концентрация электролита.
Это положение теории прекрасно объясняет особенности коллигативных свойств разбавленных растворов электролитов. Известно, что осмотическое давление разбавленного раствора хлорида натрия почти в два раза больше рассчитанного по уравнению Вант-Гоффа, если в него подставить молярную концентрацию соли. Во столько же раз больше окажется понижение давления пара над раствором по сравнению с расчетом по закону Рауля, а также понижение температуры замерзания и повышение температуры кипения.
Я. Вант-Гофф, характеризуя осмотические свойства растворов электролитов, ввел первоначально определяемую эмпирически величину, называемую изотоническим факторомi, который представляет собой отношение экспериментально определяемого осмотического давления Pэксп. к величине, рассчитываемой по уравнению Вант-Гоффа для данной молярной концентрации вещества Pтеорет.:
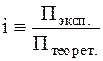 .
.
Для сильного бинарного электролита a = 1 и число частиц вещества в растворе превышает его молярную концентрацию вдвое. Для слабого бинарного электролита молярная концентрация всех частиц в растворе С связана с молярной концентрацией вещества С0 соотношением (3 - 1). Следовательно,
Pтеорет. = C0RT,
Pэксп. = СRT = (1 +a)C0RT,
i = 1 + a.
Если сумма катионов и анионов для данного электролита составляет n (например, для K2SO4 n = 3, а для AlCl3 n = 4), то общая формула для расчета изотонического фактора такова:
i = 1 + a(n – 1).
Таким образом, на основании данных по осмотическому давлению можно рассчитать степень диссоциации электролита.
Аналогично можно использовать данные по понижению давления пара над раствором, понижению температуры замерзания и повышению температуры кипения растворов.
II. Теория электролитической диссоциации объяснила независимость теплоты реакции нейтрализации от природы сильных кислот и оснований. Действительно, при одинаковых нормальных концентрациях серной, соляной, азотной, хлорной и др. сильных кислот в растворе должны содержаться одинаковые концентрации ионов водорода, а при одинаковых нормальных концентрациях гидроксидов натрия, калия, бария и других сильных оснований в растворах содержатся одинаковые концентрации гидроксид-ионов. После смешивания растворов взаимодействие ионов водорода и гидроксид-ионов приводит к образованию воды:
Н+ + ОН- = Н2О,
а другие ионы останутся в растворе.
III. Теория электролитической диссоциации объяснила особенности каталитического действия кислот и оснований.
Экспериментально было установлено, что каталитическое действие кислот и оснований в реакциях гидролиза возрастает с повышением электрической проводимости их растворов. Разумеется, чем выше электрическая проводимость раствора, тем больше концентрация ионов, включая ионы водорода и гидроксид-ионы. Следовательно, каталитической активностью обладают не все ионы, а только ионы водорода или гидроксид-ионы.
В предположении независимого существования ионов теория электролитической диссоциации позволяет объяснить закономерности изменения плотности растворов, образующихся при смешивании разбавленного раствора сильной кислоты и сильного основания, и ряд других явлений.
Однако при более высоких концентрациях проявляются закономерности, которые классическая теория электролитической диссоциации объяснить не может. В их числе - расхождения по величинам степени диссоциации, определяемой различными методами, например, по данным измерения осмотического давления и по электрической проводимости. Известны случаи, когда рассчитанная степень диссоциации для сильных электролитов оказывалась существенно меньше 1.
Классическая теория электролитической диссоциации не рассматривала механизм образования ионов в растворах.
Улучшение теории растворов электролитов шло по двум основным направлениям: учитывалось взаимодействие растворяемого вещества с растворителем и взаимодействие между ионами в растворе.
Дата добавления: 2015-07-22; просмотров: 1398;
