Периодический закон и его современная формулировка
ГЛАВА 3 ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА С ПОЗИЦИИ СОВРЕМЕННЫХ ПРЕДСТАВЛЕНИЙ ОБ АТОМАХ
Периодический закон и его современная формулировка
Изучая изменение химических свойств элементов в зависимости от величины их относительных атомных масс (атомного веса), Д. И. Менделеев в 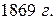 [1] составляет периодическую систему элементов, а затем формулирует Периодический закон – один из основных законов природы: свойства элементов, а потому и свойства образуемых ими простых и сложных соединений находятся в периодической зависимости от их атомных масс.
[1] составляет периодическую систему элементов, а затем формулирует Периодический закон – один из основных законов природы: свойства элементов, а потому и свойства образуемых ими простых и сложных соединений находятся в периодической зависимости от их атомных масс.
Этот закон позволил провести не только строго научную классификацию элементов, уточнить значения атомных масс и валентностей некоторых из них, но он еще обладал огромной предсказательной способностью при открытии новых элементов.
Однако, наряду с бесспорными достоинствами периодического закона, имелись и существенные недостатки, которые ни Д. И. Менделеев, ни его последователи не могли объяснить, например, аномальное расположение элементов: 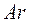 и
и 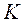 ,
, 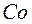 и
и 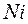 ,
, 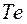 и
и 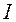 . Только в
. Только в 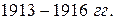 после работ английского физика Мозли удалось понять эти аномалии. Исследуя рентгеновское излучение атомов, Мозли установил закон:
после работ английского физика Мозли удалось понять эти аномалии. Исследуя рентгеновское излучение атомов, Мозли установил закон:
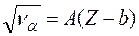 ,
, 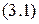
где 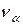 - частота рентгеновского излучения,
- частота рентгеновского излучения,
 – положительный заряд ядра или порядковый номер элемента,
– положительный заряд ядра или порядковый номер элемента,
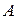 и
и 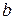 – постоянные,
– постоянные,
который читается следующим образом: корень квадратный из частоты рентгеновского излучения пропорционален порядковому номеру элемента. Следовательно, основной характеристикой атома является ни его атомная масса (по Менделееву), а заряд ядра.
Поскольку химические свойства элементов обусловлены строением электронных оболочек атомов, то периодическая система Менделеева представляется естественной классификацией элементов по их электронным структурам. Но при образовании химической связи электроны перераспределяются между атомами, а заряд ядра остаётся неизменным, поэтому современная формулировка периодического законагласит: свойства элементов, а также простых и сложных соединений находятся в периодической зависимости от зарядов ядер их атомов.
Указанные отступления от периодического закона объясняются существованием изотопов, так как большинство химических элементов в природе представляют собой естественную их смесь.
Изотопы – это разновидность атомов данного элемента, которые имеют один и тот же заряд ядра (содержат одинаковое число протонов в ядре), но различные массовые числа (содержат разное число нейтронов в ядре).
Поэтому относительная масса элемента с учётом его изотопного состава равна:
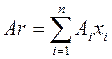 ,
, 
где 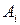 – относительная атомная масса каждого сорта
– относительная атомная масса каждого сорта 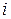 изотопов, составляющих данный элемент,
изотопов, составляющих данный элемент, 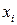 – доля изотопа
– доля изотопа 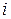 в элементе. Например, рассчитаем относительные атомные массы элементов калия
в элементе. Например, рассчитаем относительные атомные массы элементов калия 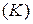 и аргона
и аргона  . Калий имеет
. Калий имеет 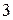 изотопа с относительными атомными массами:
изотопа с относительными атомными массами:
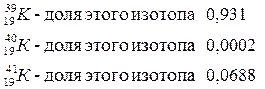
Тогда, используя формулу 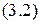 , получим:
, получим:
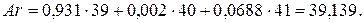
Аргон имеет также  изотопа с относительными атомными массами:
изотопа с относительными атомными массами:
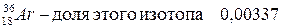 .
.
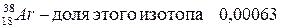 .
. 
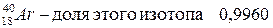 .
.
Поступая аналогично, будем иметь:
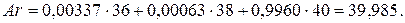
Поскольку заряд ядра атома аргона 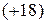 , а атома калия
, а атома калия 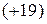 , то несмотря на большую относительную массу элемента
, то несмотря на большую относительную массу элемента 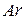 , он находится в периодической таблице Д. И. Менделеева впереди атома калия.
, он находится в периодической таблице Д. И. Менделеева впереди атома калия. 
Именно этим обстоятельством объясняются также нецелочисленные значения атомных масс химических элементов.
Формулировка периодического закона, которую дал Д. И. Менделеев, и современная формулировка в принципе не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядер атомные массы также увеличиваются.
Дата добавления: 2015-07-18; просмотров: 1345;
