Принципы построения периодической системы элементов
Явление периодичности с позиций современного строения атомов объясняется тем, что через определённое число элементов появляются элементы с аналогичной электронной структурой. Например, рассмотрим элементы 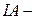 группы:
группы:
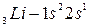 .
.
 .
.
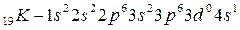 .
.
Периодическая система состоит из периодов, рядов и групп.
Период – горизонтальный ряд элементов, имеющий одинаковое число энергетических уровней (электронных слоёв), номер периода совпадает со значением главного квантового числа 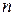 внешнего уровня (слоя). Периодов в системе
внешнего уровня (слоя). Периодов в системе 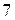 , их них
, их них 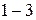 короткие,
короткие, 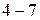 длинные, которые имеют чётные и нечётные ряды (таблица
длинные, которые имеют чётные и нечётные ряды (таблица 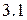 ). Каждый период начинается типичным металлом (щелочным элементом), имеющим электронную конфигурацию
). Каждый период начинается типичным металлом (щелочным элементом), имеющим электронную конфигурацию 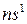 , а при переходе слева направо происходит постепенное ослабление металлических и нарастание неметаллических свойств; заканчивается период благородным газом
, а при переходе слева направо происходит постепенное ослабление металлических и нарастание неметаллических свойств; заканчивается период благородным газом 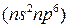 .
.
По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – 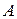 , состоящие из
, состоящие из 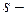 и
и 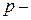 элементов, и побочные –
элементов, и побочные – 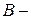 подгруппы,содержащие
подгруппы,содержащие  и
и 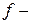 элементы. Подгруппа
элементы. Подгруппа  , кроме
, кроме  элементов, содержит по
элементов, содержит по 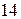
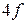 и
и 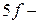 элементов. Это семейства лантаноидов и актиноидов соответственно. Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
элементов. Это семейства лантаноидов и актиноидов соответственно. Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на 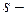 и
и 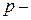 орбиталях внешнего энергетического уровня, в побочных – на
орбиталях внешнего энергетического уровня, в побочных – на 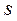 -орбиталях внешнего и
-орбиталях внешнего и  орбиталях предвнешнего слоя. Для
орбиталях предвнешнего слоя. Для 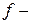 элементов валентными являются
элементов валентными являются  , где
, где 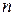 равно
равно 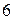 или
или 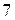 для лантаноидов и актиноидов соответственно.
для лантаноидов и актиноидов соответственно.
Сходство элементов внутри каждой подгруппы – наиболее важная закономерность в периодической системе; они называются элементами – аналогами.
Рассмотрим 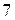 группу.
группу. 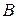 главной подгруппе находятся типичные неметаллы – галогены (
главной подгруппе находятся типичные неметаллы – галогены ( 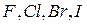 ), в побочной подгруппе – элементы, проявляющие достаточно сильные металлические свойства (
), в побочной подгруппе – элементы, проявляющие достаточно сильные металлические свойства ( 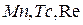 ). Несмотря на столь разные свойства, эти элементы объединены в одну группу потому, что они имеют одинаковое число валентных электронов:
). Несмотря на столь разные свойства, эти элементы объединены в одну группу потому, что они имеют одинаковое число валентных электронов:
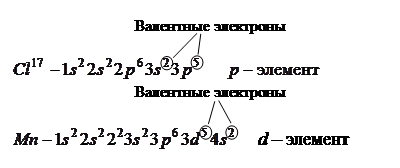
В разных подгруппах эти элементы находятся потому, что они обладают различными электронными конфигурациями валентных электронов.
По типу заполнения подуровней электронами элементы разделяются на 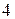 электронных семейства:
электронных семейства:
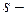 элементы – это элементы, в атомах которых последним заполняется
элементы – это элементы, в атомах которых последним заполняется 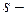 подуровень внешнего электронного слоя (их
подуровень внешнего электронного слоя (их  ):
): 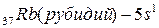 ;
;
 элементы – последним заполняется
элементы – последним заполняется 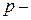 подуровень внешнего электронного слоя (их
подуровень внешнего электронного слоя (их 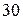 ):
): 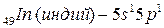 ;
;
 -элементы – последним идёт заполнение
-элементы – последним идёт заполнение 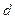 -подуровня предвнешнего электронного слоя (их 35):
-подуровня предвнешнего электронного слоя (их 35): 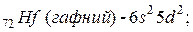
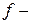 элементы – в атомах которых последним заполняется
элементы – в атомах которых последним заполняется  подуровень третьего снаружи электронного слоя (их
подуровень третьего снаружи электронного слоя (их  ):
): 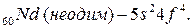 Только актиноиды (в основном) имеют электронную конфигурацию валентных электронов, указанную выше:
Только актиноиды (в основном) имеют электронную конфигурацию валентных электронов, указанную выше: 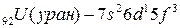 .
.
Всё сказанное подтверждает, что структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома. Далее рассматриваются некоторые периодические свойства элементов.
Связь между электронным строением элементов и их положением в периодической системе представлена в таблице  :
:
Первый период (n = 1, l = 0) состоит из двух элементов 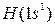 и
и 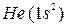 .
.
Во втором периоде (n = 2, l = 0, 1) заполняются 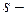 и
и 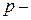 орбитали от
орбитали от 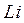 до
до 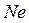 . Элементы называются соответственно
. Элементы называются соответственно 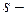 и
и 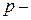 элементами.
элементами.
В третьем периоде появляются пять d-орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны, и третий период, как и второй, содержит восемь 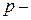 элементов от
элементов от 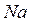 до
до 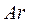 . Следующие за аргоном калий и кальций имеют на внешнем уровне
. Следующие за аргоном калий и кальций имеют на внешнем уровне 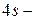 электроны (четвёртый период). Появление
электроны (четвёртый период). Появление 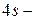 электронов при наличии свободных
электронов при наличии свободных 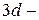 орбиталей обусловлено экранированием ядра плотным
орбиталей обусловлено экранированием ядра плотным  -электронным слоем (эффект экранирования). В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются
-электронным слоем (эффект экранирования). В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются 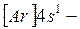 и
и 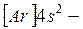 -состояния. При дальнейшем увеличении заряда у следующего за кальцием скандия
-состояния. При дальнейшем увеличении заряда у следующего за кальцием скандия 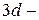 состояние становится энергетически более выгодным, чем
состояние становится энергетически более выгодным, чем 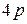 , поэтому и заселяется
, поэтому и заселяется 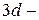 орбиталь. Приведённые рассуждения подтверждаются экспериментальными данными об изменении энергии
орбиталь. Приведённые рассуждения подтверждаются экспериментальными данными об изменении энергии 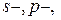
 и
и 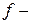 орбиталей в зависимости от порядкового номера элемента. Как следует из рисунка
орбиталей в зависимости от порядкового номера элемента. Как следует из рисунка 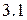 , значения энергии различных состояний зависят от заряда ядра
, значения энергии различных состояний зависят от заряда ядра  , и чем больше
, и чем больше  , тем меньше различаются эти состояния по энергиям. Характер этого различия таков, что кривые, выражающие изменение энергии, пересекаются.
, тем меньше различаются эти состояния по энергиям. Характер этого различия таков, что кривые, выражающие изменение энергии, пересекаются.
Так, для элементов 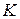 и
и 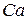 (
( 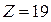 и
и 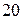 ) энергия
) энергия 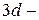 орбиталей выше, чем
орбиталей выше, чем 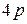 , а для элементов с
, а для элементов с 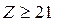 энергия
энергия 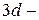 орбиталей ниже, чем
орбиталей ниже, чем 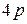 . Начиная со скандия
. Начиная со скандия 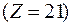 , заполняется
, заполняется 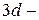 орбиталь, а во внешнем слое остаются
орбиталь, а во внешнем слое остаются 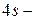 электроны. Поэтому в четвёртом периоде в ряду от
электроны. Поэтому в четвёртом периоде в ряду от 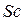 до
до 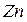 все десять
все десять 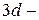 элементов – металлы с низшей степенью окисления, как правило,
элементов – металлы с низшей степенью окисления, как правило, 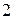 , за счёт внешних
, за счёт внешних 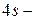 электронов. Общая электронная формула этих элементов
электронов. Общая электронная формула этих элементов 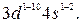 Для хрома и меди наблюдается проскок (или провал) электрона на
Для хрома и меди наблюдается проскок (или провал) электрона на 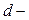 подуровень:
подуровень: 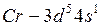 ,
, 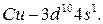 Такой проскок с
Такой проскок с 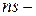 на
на 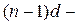 уровень наблюдается также у
уровень наблюдается также у 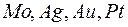 и некоторых других элементов и объясняется близостью энергий
и некоторых других элементов и объясняется близостью энергий 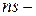 и
и 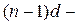 уровней и стабильностью наполовину и полностью заполненных уровней. Этот эффект называется эффектом проскока электрона.
уровней и стабильностью наполовину и полностью заполненных уровней. Этот эффект называется эффектом проскока электрона.

Рисунок 3.1 – Зависимость энергии электрона от порядкового номера элемента
Образование катионов 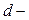 элементов связано с потерей, прежде всего, внешних
элементов связано с потерей, прежде всего, внешних 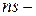 и только затем
и только затем 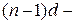 электронов. Например:
электронов. Например:
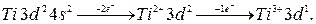
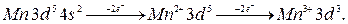
Дальше в четвёртом периоде после 10 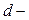 элементов появляются
элементов появляются  элементы от
элементы от 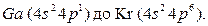
Пятый период повторяет четвёртый, в нём также 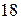 элементов, и
элементов, и 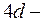 элементы, как и
элементы, как и 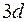 ,образуют вставную декаду
,образуют вставную декаду 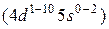 .
.
В шестом периоде после лантана  – аналога скандия и иттрия, следуют
– аналога скандия и иттрия, следуют 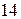
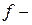 элементов – лантаноидов. Свойства этих элементов очень близки, поскольку идёт заполнение глубоколежащего
элементов – лантаноидов. Свойства этих элементов очень близки, поскольку идёт заполнение глубоколежащего 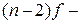 подуровня. Общая формула лантаноидов
подуровня. Общая формула лантаноидов 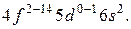
Ионы 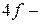 элементов образуются следующим образом:
элементов образуются следующим образом:
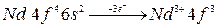 ,
,
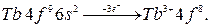
После 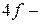 элементов заполняются
элементов заполняются 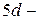 и
и 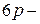 орбитали.
орбитали.
Седьмой период отчасти повторяет шестой. 5 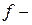 элементы называются актиноидами. Их общая формула
элементы называются актиноидами. Их общая формула  Далее следует ещё
Далее следует ещё 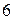 искусственно полученных
искусственно полученных 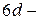 элементов незавершенного седьмого периода.
элементов незавершенного седьмого периода.
Дата добавления: 2015-07-18; просмотров: 1856;
