Энергия ионизации
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбуждённого атома или иона.
Энергия ионизации 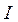 выражается в
выражается в 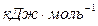 :
: 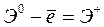 ,
, 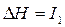 – первый потенциал ионизации;
– первый потенциал ионизации; 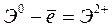 ,
, 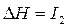 – второй потенциал ионизации и т.д. Причём
– второй потенциал ионизации и т.д. Причём 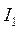 <
< 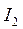 <
< 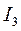 <
< 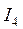 … (Э – элемент).
… (Э – элемент).
Энергия ионизации характеризует металлические (восстановительные) свойства элементов. Чем меньше энергия ионизации, тем в большей мере элемент проявляет металлические свойства.
Таблица 3.4 – Энергия ионизации атомов некоторых металлов
| 
| |||
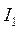
| 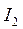
| 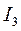
|  
| |
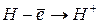
| 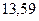
| - | - | 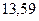
|
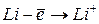
| 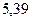
| - | - | 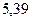
|
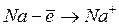
| 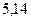
| - | - | 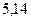
|
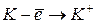
| 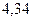
| - | - | 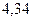
|
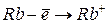
| 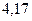
| - | - | 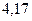
|

| 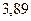
| - | - | 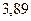
|
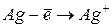
| 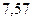
| - | - | 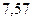
|
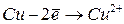
| 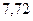
| 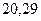
| - | 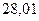
|
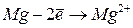
| 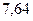
| 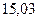
| - | 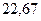
|
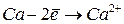
| 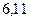
| 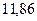
| - | 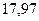
|
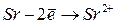
| 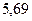
| 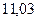
| - | 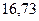
|
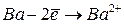
| 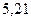
| 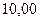
| - | 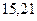
|
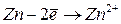
| 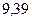
| 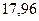
| - | 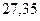
|
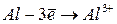
| 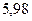
| 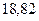
| 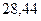
| 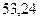
|
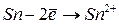
| 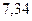
| 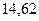
| - | 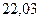
|
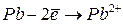
| 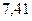
| 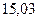
| - | 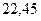
|
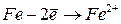
| 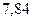
| 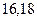
| - | 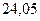
|
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рисунок 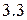 ), а её численные значения для некоторых из них приведены в таблице
), а её численные значения для некоторых из них приведены в таблице 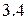
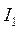 максимальна у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду
максимальна у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду 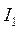 резко понижается – она минимальна у щелочных металлов.
резко понижается – она минимальна у щелочных металлов.
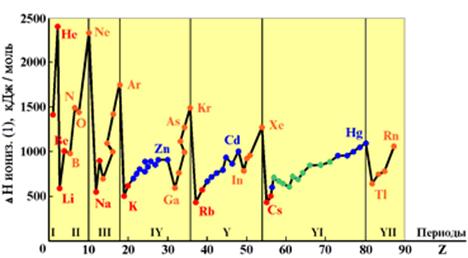
Рисунок 3.3 Потенциалы ионизации нейтральных атомов
Энергия связи электрона с ядром пропорциональна 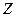 и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы
и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы 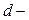 и
и 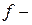 элементов с ростом
элементов с ростом 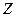 в периоде уменьшаются незначительно по сравнению с
в периоде уменьшаются незначительно по сравнению с 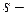 и
и 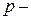 элементами, поэтому их потенциалы растут также незначительно.
элементами, поэтому их потенциалы растут также незначительно.
В главных подгруппах потенциалы ионизации с ростом 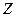 уменьшаются вследствие увеличения числа электронных оболочек и экранирования заряда ядра электронами внутренних оболочек.
уменьшаются вследствие увеличения числа электронных оболочек и экранирования заряда ядра электронами внутренних оболочек.
В побочных подгруппах 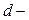 электроны экранируются не только электронами заполненных оболочек, но и внешними
электроны экранируются не только электронами заполненных оболочек, но и внешними 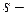 электронами. Поэтому потенциал ионизации
электронами. Поэтому потенциал ионизации 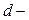 элементов с ростом
элементов с ростом 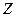 в подгруппе увеличивается, хотя и незначительно.
в подгруппе увеличивается, хотя и незначительно.
Чем меньше потенциал ионизации, тем легче атом отдаёт электрон. Поэтому восстановительная способность нейтральных атомов с ростом 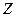 в периоде уменьшается, в главных подгруппах растёт, а в побочных падает.
в периоде уменьшается, в главных подгруппах растёт, а в побочных падает.
Дата добавления: 2015-07-18; просмотров: 942;
