Валентность
Одной из важнейших характеристик элемента является валентность.
Классическое определение:Валентность – это свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента при образовании химической связи в молекуле.
Современное определение: Валентность элемента определяется числом неспаренных электронов в его атоме.
Существуют элементы с постоянной и переменной валентностью.
Атомы многих элементов могут увеличивать свою валентность (число неспаренных электронов) в результате перехода из основного в возбуждённое состояние. Возбуждённое состояние атома – это состояние с более высокой энергией, чем основное.
Рассмотрим атомы кислорода и серы. Они имеют одинаковую электронную конфигурацию внешнего энергетического уровня:

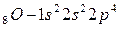
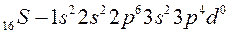
потому, что находятся в главной подгруппе 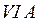 группы. В основном (невозбуждённом) состоянии они имеют по два неспаренных электрона на внешнем энергетическом уровне и поэтому имеют одинаковую валентность, равную двум.
группы. В основном (невозбуждённом) состоянии они имеют по два неспаренных электрона на внешнем энергетическом уровне и поэтому имеют одинаковую валентность, равную двум.
Однако атом серы может перейти в возбуждённое состояние (при получении дополнительной энергии) за счет перехода электронов с 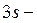 и
и 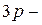 подуровней на свободные орбитали
подуровней на свободные орбитали 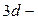 подуровня:
подуровня:
 Основное состояние
Основное состояние
Валентность 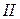
Возбуждённое состояние
Валентность 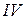
Валентность 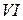
Это является причиной переменной валентности серы. Причём распаривание электронов и переход их с одного подуровня на свободную орбиталь другого подуровня может осуществляться только в пределах одного и того же энергетического уровня.
 |
Например:
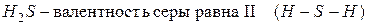
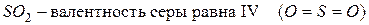
Другая ситуация наблюдается для атома кислорода. Он не может перейти в возбуждённое состояние, потому что на втором энергетическом уровне отсутствует 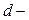 подуровень, т.е. нет свободных орбиталей, на которые могли бы перейти электроны. Именно поэтому валентность кислорода постоянна во всех его соединениях.
подуровень, т.е. нет свободных орбиталей, на которые могли бы перейти электроны. Именно поэтому валентность кислорода постоянна во всех его соединениях.
 |
Аналогично ведёт себя 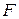 , который также имеет постоянную валентность
, который также имеет постоянную валентность  , в отличие от всех других галогенов
, в отличие от всех других галогенов 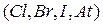 , проявляющих валентность
, проявляющих валентность 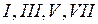 .
.
Для большинства элементов максимальное число неспаренных электронов в основном или возбуждённом состоянии равно номеру группы, в которой находится элемент. Поэтому высшая валентность элементов, как правило, равна номеру группы.
Валентность элемента может быть и больше числа неспаренных электронов в атоме, если атом образует не только ковалентные, но и донорно-акцепторные связи.
 Например, атом азота в основном состоянии имеет три неспаренных электрона:
Например, атом азота в основном состоянии имеет три неспаренных электрона:
 Валентность
Валентность 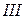
Такую валентность азот имеет в молекуле аммиака  :
:
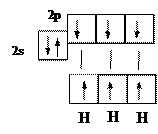
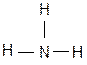 или
или
Но атом азота имеет ещё  орбиталь с неподелённой электронной парой, которая может участвовать в образовании донорно-акцепторной связи. В роли акцептора электронов могут выступать ион водорода
орбиталь с неподелённой электронной парой, которая может участвовать в образовании донорно-акцепторной связи. В роли акцептора электронов могут выступать ион водорода 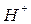 или другие частицы, которые имеют свободные орбитали. Поэтому, например, в ионе аммония
или другие частицы, которые имеют свободные орбитали. Поэтому, например, в ионе аммония 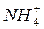 азот образует уже
азот образует уже 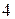 связи и его валентность равна
связи и его валентность равна 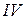 :
:

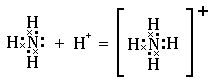
Из вышесказанного вытекает более полное определение валентности. Валентность элемента определяется числом орбиталей, которые атом данного элемента может использовать для образования химических связей.
Это могут быть:
а) орбитали с неспаренными электронами;
б) свободные орбитали;
в) орбитали с неподелёнными электронными парами.
Дата добавления: 2015-07-18; просмотров: 3088;
