Изменения свойств некоторых их сложных соединений
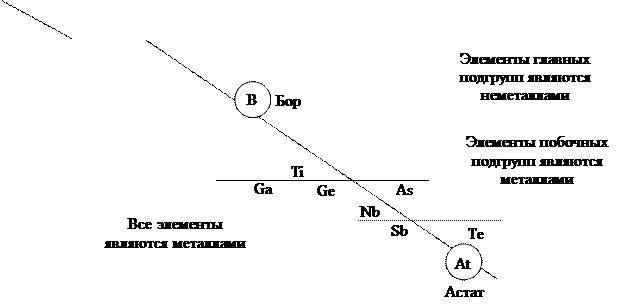
Так как в периодах и группах периодической системы Д.И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, то можно достаточно определённо указать положение металлов и неметаллов в периодической системе. Если провести диагональ (таблица 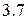 ) от элемента бора
) от элемента бора 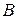 (порядковый номер
(порядковый номер 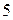 ) до элемента астата
) до элемента астата 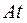 (порядковый номер
(порядковый номер 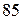 ), то слева от этой диагонали все элементы являются металлами, а справа от неё элементы побочных подгрупп – металлы, а элементы главных подгрупп – неметаллы. Элементы расположенные вблизи диагонали (например,
), то слева от этой диагонали все элементы являются металлами, а справа от неё элементы побочных подгрупп – металлы, а элементы главных подгрупп – неметаллы. Элементы расположенные вблизи диагонали (например, 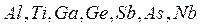 ) обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов (
) обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов ( 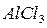 и
и 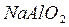 )
)
Tаблица 3.7 – Положение элементов металлов и неметаллов в периодической системе
 Группы Группы
| I | II | III | IV | V | VI | VII | VIII |
| Периоды | ||||||||
| Al | ||||||||
Все 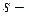 элементы (кроме
элементы (кроме 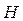 и
и 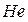 ),
), 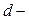 элементы (все элементы побочных подгрупп) и
элементы (все элементы побочных подгрупп) и 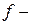 элементы (лантаноиды и актиноиды) являются металлами.
элементы (лантаноиды и актиноиды) являются металлами.
Среди 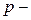 элементов есть металлы и неметаллы.
элементов есть металлы и неметаллы.
Деление элементов на металлы и неметаллы объясняется различием в строении атомов. Атомы большинства металлов на внешнем энергетическом уровне имеют от 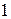 до
до 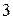 электронов. Исключение: атомы германия
электронов. Исключение: атомы германия 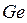 , олова
, олова 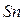 , свинца
, свинца 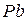 на внешнем электроном слое имеют четыре электрона, атомы сурьмы
на внешнем электроном слое имеют четыре электрона, атомы сурьмы 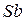 , висмута
, висмута 
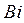 – пять, атомы полония
– пять, атомы полония 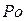 – шесть. Атомы металлов имеют меньший заряд и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром у них значительно меньше, чем у неметаллов, и они легко отдают валентные электроны, превращаясь в положительно заряженные ионы.
– шесть. Атомы металлов имеют меньший заряд и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром у них значительно меньше, чем у неметаллов, и они легко отдают валентные электроны, превращаясь в положительно заряженные ионы.
Простые вещества, которые образуют элементы – металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути, которая является жидкостью). Сопоставляя свойства простых веществ, а также водородные и кислородные соединения элементов, можно сделать следующие выводы:
1) свойства простых веществ изменяются от металлических к неметаллическим;
2) элементы (за исключением гелия, неона, и аргона) образуют водородные и кислородные соединения, физические свойства которых изменяются от твердых к газообразным ( 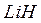 и
и 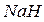 ,
, 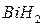 и
и 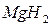 – твердые гидриды;
– твердые гидриды; 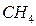 и
и 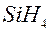 ,
, 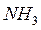 и
и 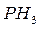 – газообразные водородные соединения;
– газообразные водородные соединения; 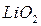 и
и 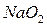 ,
, 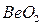 и
и 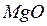 – твердые оксиды;
– твердые оксиды; 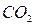 ,
, 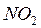 ,
, 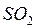 – газообразные оксиды).
– газообразные оксиды).
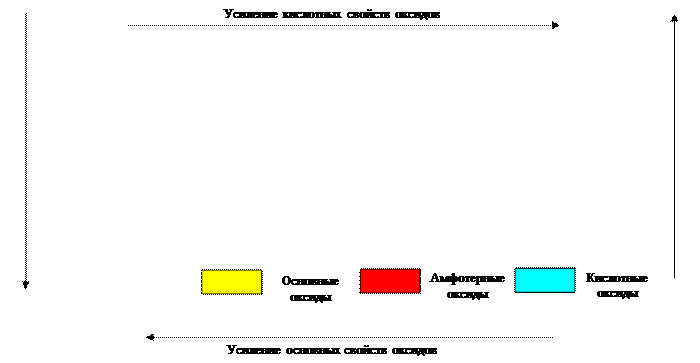
3) свойства оксидов и гидроксидов изменяются от основных к кислотным через амфотерные как внутри периода, так и внутри группы (таблица 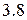 ). В периоде слева направо основный характер оксидов и гидроксидов постепенно ослабляется, сменяясь амфотерным. К концу периода усиливаются кислотные свойства. Каждый период начинается элементом, оксид и гидроксид которого обладают ярко выраженными основными свойствами, и заканчивается элементом, оксиды и гидроксиды которого при максимальной степени окисления центрального атома – сильные кислоты.
). В периоде слева направо основный характер оксидов и гидроксидов постепенно ослабляется, сменяясь амфотерным. К концу периода усиливаются кислотные свойства. Каждый период начинается элементом, оксид и гидроксид которого обладают ярко выраженными основными свойствами, и заканчивается элементом, оксиды и гидроксиды которого при максимальной степени окисления центрального атома – сильные кислоты.
В каждой главной подгруппе (кроме 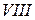 ) сверху вниз усиливается основный характер оксидов и гидроксидов, кислотные же свойства ослабевают.
) сверху вниз усиливается основный характер оксидов и гидроксидов, кислотные же свойства ослабевают.
В главных подгруппах  групп содержатся также элементы, оксиды которых обладают амфотерными свойствами.
групп содержатся также элементы, оксиды которых обладают амфотерными свойствами.
Таблица 3.8 Изменение свойств оксидов в периодической системе Д.И. Менделеева
| I | II | III | IV | V | VI | VII | VIII | |
   H H
| He | |||||||
| Li | Be | B | C | N | O | F | Ne | |
| Na | Mg | Al | Si | P | S | Cl | Ar | |
| K | Ca | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | |||||||
Дата добавления: 2015-07-18; просмотров: 910;
