Системи культивування іммобілізованих клітин
Існує 2 типи систем культивування іммобілізованих клітин:
1. Система культури з плоскою основою, клітини вирощуються в горизонтально розташованій посудині.
2. Система культури на колонці, де клітини вирощуються у вертикальній посудині.
В обох системах рідке середовище циркулює навколо фізично нерухомих клітин.
Система культури з плоскою основою (рис. 3)

Рис. 3. Система культури з плоскою основою.
Поживне середовище капає під дією сили тяжіння з циліндричної посудини об'ємом 70 мл (1) в скляну посудину для культивування (3) обсягом 350 мл, де знаходяться клітини (40 – 50 г сирої маси), посаджені на субстрат – підстилку з нетоксичної поліпропіленової тканини. Поживне середовище проникає крізь тканину під дією капілярних сил, живлячи клітини. Після цього використане поживне середовище відкачується з посудини для культивування за допомогою перистальтичного насоса (2) назад у резервуар і використовується повторно.
Дослідження, проведені з цією системою, показали, що клітини Solanum niger, культивовані на плоскій основі (середовище Мурасіге-Скуга з додаванням 2,4-Д і кінетину) здатні споживати поживні речовини і швидко реагують на недолік ортофосфату. Збільшення сирої маси йде набагато повільніше, ніж у суспензійних культурах. Кількість життєздатних клітин таке ж і сягає 70 – 80%. Кількість алкалоїдів через 7 діб культивування досягає 12 мг/г сухої маси, в суспензії ж через 18 днів культивування воно становить 10 мг/г сухої маси. У місцях, де поживне середовище капає прямо на клітини, через 3 – 4 дні культивована тканина стає темною і відрізняється від решти, яка у S. niger забарвлена в світло-бежевий колір. Клітини в зонах капання часто бувають більш компактні, містять більше алкалоїдів. Якщо клітини ізолювати із зон капання і помістити в чашки Петрі з агаром, вміст алкалоїдів падає, при поверненні в колишні умови культивування знову акумулюються високі кількості метаболітів.
Крім того, в клітини вводилися попередники вторинних метаболітів. Відзначено, що синтез капсацину клітинами Capsicum frutencens збільшується в тисячі разів при додаванні в середовище 5 мл ізокапринової кислоти. При цьому капсацин не накопичується всередині клітин, а секретується в поживне середовище. Встановлено, що клітини, іммобілізовані на плоскій основі, здатні споживати поживні речовини з середовища, у тому, числі і кисень, мають низьку швидкість росту, каллусоподібне розташування, здатні до тісного міжклітинного контакту. У цілому, вони мають більш високий рівень синтезу вторинних метаболітів.
Незважаючи на ці переваги, промислове культивування має істотний недолік: горизонтальна конструкція апарату створює незручності при роботі і вимагає великої площі. Ці недоліки усуваються в іншій системі. Система культури на колонці (рис. 4).
У такій системі зростає число клітин, на які капає середовище, що збільшує "зону капання", де відбувається накопичення великих кількостей вторинних метаболітів.
Посудина для культивування з горизонтальної перетворюється на вертикальну. У посудині з поживним середовищем (1) 50 мл рідкого середовища, яка під дією сили тяжіння капає у вертикальну скляну колонку, що містить іммобілізовані клітини (3). Середовице збирають з дна колонки і знову використовують у циклі, перекачуючи за допомогою перистальтичного насоса в резервуар із середовищем.
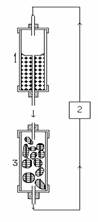
Рис. 4. Система культури в колонці.
Як розмістити клітини всередині колонки, щоб капаюче середовище не спресувало їх у щільну масу на дні колонки? Закріпити в нейлонову мережу, кошики, використовуючи інертний, проникний і стабільний гель. Між кошиками утворюється повітряний простір, сіточка структурує гель, а клітини можуть проростати через кошики, контактуючи один з одним.
Хорошим матеріалом для розміщення клітин виявилися нейлонові губки. Матеріал нетоксичний, легко ріжеться, витримує автоклавування. В якості субстратів для занурення клітин використовують агар та альгінат кальцію.
Агар традиційно використовується в роботі з культурами клітин і тканин. 2% (маса до об'єму) розчин агару в дистильованій воді автоклавують при 1 атмосфері протягом 20 хвилин і охолоджують на водяній бані до 35 – 40°С. Клітини суспензійної культури в стаціонарній фазі росту пропускають через сито з діаметром пор 1 мм і змішують в пропорції 1:1 (V:V) з незастиглим агаром. Стерильні шматочки губки 2 – 3×1×1 см за допомогою стерильного пінцета опускають в суміш клітин з агаром, а коли агар починає застигати, поміщають у стерильні колонки з внутрішнім діаметром 15×2,5 см. У кожну колонку поміщають приблизно 10 сіточок, таким чином, на колонку припадає 5 – 7 г сирої маси клітин.
Аналогічно мобілізують клітини з використанням альгінату кальцію. У цьому інертному субстраті, наприклад, успішно були іммобілізовані А. Альферманном зі співробітниками клітини наперстянки шерстистої (Digitalis lanata). 2% розчин альгінату натрію автоклавують, охолоджують до кімнатної температури, змішують з клітинами і переносять у стерильний розчин 0,05 М CaCl2 у дистильованій воді на 10 хвилин, щоб альгінат кальцію, який утворився, затвердів всередині і навколо шматочків губки, обгортаючи клітини. Молекули альгінату поперечно зшиваються катіонами кальцію, при цьому відбувається його стабілізація. Затверділий матеріал тричі промивають у стерильній дистильованій воді і вносять у скляні колонки.
Як показали подальші дослідження, ріст клітин у альгінаті був кращим, ніж в агарі, що пов'язано, ймовірно, з негативною дією розплавленого агару, температура якого складає близько 40°С, на клітиини в процесі іммобілізації. Тому експерименти по зміні умов навколишнього середовища проводилися у колонках, де клітини Datura innoxia і Capsicum frutencens були іммобілізовані в альгінаті кальцію.
Швидкість споживання ортофосфату, нітратів, амонію і сахарози в клітинах колоночної культури нижча, ніж в горизонтальній системі. Життєздатність клітин, в порівнянні з суспензійними культурами, помітно не знижується (60 – 65%), вміст алкалоїдів через 8 – 10 діб становить 12 – 13 мг / г сухої маси клітин, алкалоїди в поживне середовище не виділяються, а рН середовища після 8 діб культивування знижується на 0,4 одиниці, до 5,4. Визначення швидкості споживання кисню показує можливу нестачу його на 4 – 8 добу культивування.
Культури, які освітлюються люмінесцентними лампами, споживають поживні речовини інтенсивніше, ріст клітин кращий також в освітлених культурах. У світлокультурі підвищується життєздатність клітин і вміст алкалоїдів.Так як клітини не зеленіють, для підтримки нормального клітинного метаболізму необхідні й інші світлові ефекти.
Додавання попередників не завжди однозначно впливає на ріст, споживання поживних речовин і синтез метаболітів. Наприклад, дія орнитину на клітини Datura innoxia скоріше негативна, а ізокапринової кислоти на клітини Capsicum frutencens – скоріше позитивна, так як сира маса збільшується, але вихід капсоміцину залишається тим самим. В обох випадках синтез метаболітів не інгібується альгінатним гелем.
Отримані результати свідчать про збереження життєздатності клітин багатьох видів рослин при іммобілізації. Іммобілізовані клітини, отримані з пухких, швидко зростаючих суспензійних культур, сповільнюють ріст і набувають схожість з клітинами каллусних культур. Ці клітини більш взаємозв'язані, ніж в рідкій культурі, що веде до виникнення певного фізичного і хімічного градієнтів.
Іммобілізовані клітини акумулюють більше алкалоїдів, ніж в рідкій культурі, що веде до виникнення певних фізичних і хімічних градієнтів. Це сприяє переходу клітин в стаціонарну фазу, що призводить до прискорення утворення алкалоїдів та інших речовин вторинного походження.
Загальні рекомендації до культивування клітин на основі отриманих результатів.
Клітини повинні вирощуватися фізично стаціонарно, у тісному контакті одина з одною, щоб стимулювався розвиток фізичних і хімічних градієнтів і забезпечувалася часткова диференціація культури. Деякі види рослин необхідно культивувати при освітленні і індукувати утворення хлоропластів, щоб забезпечити рівень метаболізму, близький до того, що відбувається в клітинах інтактної рослини.
Склад поживного середовища та рівень кисню потрібно регулювати для уповільнення росту культури. Рекомендується використовувати регулятори росту для імітації процесів диференціації, що відбуваються in vivo.
Клітини необхідно постачати попередниками, але у низьких концентраціях. Попередники повинні бути максимально близькі в ланцюжку перетворень до вихідного продукту.
Бажано використовувати клітини, які секретують необхідні метаболіти в поживне середовище або клітини, у яких таку секрецію можна індукувати.
Дата добавления: 2015-07-14; просмотров: 907;
