Методики культивування одиночних рослинних клітин
Окремі клітини культивують для отримання клонів, вивчення їх генетичної та фізіологічної мінливості або стабільності. Крім того, культивування окремих клітин дозволяє вивчати умови, що визначають виникнення стимулів до ділення у клітин, ізольованих від впливу інших клітин популяції або тканини. Окремі клітини також важливі для клонової селекції мутантних, гібридних і трансформованих ліній. Як правило, у такі клітини вводять маркерні гени, які дозволяють здійснювати селекцію.
Крім того, окремі клітини можуть слугувати моделлю для порівняльного вивчення фізіологічних процесів у тканині та ізольованої клітці. Наприклад, для вивчення фотодихання можна порівнювати процес фотосинтезу на рівні окремих клітин мезофілу листка і цілої тканини.
Вирощування ізольованих клітин складається з двох етапів: 1) ізолювання непошкодженої клітини рослинної або каллусної тканини; 2) створення умов, сприятливих для росту і розвитку ізольованої клітини.
На першому етапі необхідно виділити неушкоджену і життєздатну клітину з тканини цілої рослини або каллусної тканини. Цього можна досягти шляхом обробки тканини пектиназою, що веде до мацерації її клітин. Однак не завжди після такої обробки клітини зберігають здатність до подальших поділів і утворення тканини. Краще отримувати окремі клітини з суспензійних культур або пухкого каллусу. Ідеальними окремими клітинами є протопласти, які утворили клітинну стінку.
Далі клітини ізолюють або за допомогою мікроманіпуляторів, або шляхом ряду послідовних розведень. При перших же спробах культивування окремих клітин виникла важлива наукова проблема: як примусити ділитися клітини, ізольовані від впливу інших клітин популяції або тканин? Окремі клітини вели себе інакше, ніж їх скупчення як агрегатів в суспензії або каллусної маси на поверхні поживного середовища.
При її вирішенні виникла гіпотеза про «чинник кондиціонування». Так було названо речовину, що стимулює ділення окремих клітин. Визначено, що цей фактор має хімічну природу, термолабільний, низькомолекулярний (М.К. Павлова, Р.Г. Бутенко, 1965), видонеспецифічний, не замінює відомі фітогормони, синергічний з брасиностероїдами. Було запропоновано кілька варіантів культивування окремих клітин.
Вперше підібрати умови, що підходять для розподілу окремих клітин, вдалося в 1954 році Мьюіру, Хільденбранту і Райкеру. Цей спосіб отримав назву методу «тканини-няньки» (рис. 2).
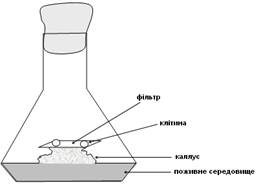
Рис. 2. Схема використання каллусу в якості «тканини-няньки».
Клітину ізолюють за допомогою мікроманіпулятора з пухкого каллусу безпосередньо на шматочок фільтра розміром 8×8 мм, поміщений на верхівку каллусної тканини, з якої була взята клітина. Каллус повинен знаходиться у фазі активного росту. Можна також як «няньку» використовувати каллусну тканину іншої рослини спорідненого виду. У цьому випадку клітини ростуть і діляться. У міру старіння каллусу-няньки фільтр з клітинами переноситься на молодий каллус. Коли тканина з клітини досягає розмірів 0,5 – 1 мм, то її можна висаджувати безпосередньо на поживне середовище.
Проводилися також експерименти з висадження клітини безпосередньо на агаризоване середовище, але обов'язково поряд з фільтром, який протягом декількох днів контактував з молодою, інтенсивно зростаючою каллусною тканиною. Оскільки ці роботи показали, що постійний контакт клітини через фільтр з каллусною масою не є обов'язковим для поділу клітини, то було запропоновано використовувати старе культуральне середовище для стимуляції одиночної клітини до поділу.
Можна також використовувати метод «годуючого шару». Для цього беруть суспензію клітин того ж виду, що і одиночна клітина, чи близького виду. Клітинна суспензія повинна знаходитися в ранній експоненційній фазі ростового циклу. У 1959 році Бергман запропонував фільтрувати суспензійну культуру (у його експериментах це були тютюн і квасоля) стерильно через один шар батисту (комірки 0,3×0,1 мм). У результаті отримували суспензію, що на 90% складається з окремих клітин. Цю суспензію змішували з агаризованому поживному середовищі того ж складу, що використовувався при культивуванні суспензії (середовище містило 0,6% агару). Суміш розливали тонким шаром (1 мм) у чашки Петрі. Агар поділяв клітини, але не перешкоджав обміну хімічними сигналами між ними, а товщина шару дозволяла спостерігати за їх поведінкою під мікроскопом.
Індукція поділів окремих клітин можлива при застосуванні дуже багатого поживного середовища, наприклад, середовища Као і Михайлюка. При цьому обсяг середовища, в яку поміщаються клітини, повинен був мінімальним (мікрокраплі обсягом до 20 мкл).
Всі ці способи культивування дозволяють клітині «відчувати» чинник кондиціонування. Він або виробляється в достатній кількості клітинами «поживного шару», «тканини-няньки», або міститься в суспензії, де раніше культивувалися клітини, або не втрачається у великому обсязі середовища. Таким чином, фактор, що викликає поділ клітин, виробляється самими клітинами, але в невеликій кількості. І тільки збільшуючи число клітин, які виробляють цей фактор, щоб він не розходився у великих обсягах поживного середовища, або ж зменшуючи обсяг середовища, в якому буде вирощуватися клітина, можна змусити її ділитися.
Дата добавления: 2015-07-14; просмотров: 1107;
