Суспензійні культури
Суспензійні культури – окремі клітини або групи клітин, що вирощуються у вигляді суспензії в рідкому середовищі. Представляють собою відносно гомогенну популяцію клітин, яку легко піддати впливу хімічних речовин.
Суспензійні культури широко використовуються як модельні системи для вивчення шляхів вторинного метаболізму, індукції ферментів та експресії генів, деградації чужорідних сполук, цитологічних досліджень та ін.
Ознакою "гарної" лінії служить здатність клітин до перебудови метаболізму і висока швидкість розмноження в конкретних умовах культивування. Морфологічні характеристики такої лінії: висока ступінь дезагрегації (5 – 10 клітин в групі); морфологічна вирівнюваність клітин (невеликі розміри, сферична або овальна форма, щільна цитоплазма); відсутність трахеєдоподобних елементів.
Клітинну суспензію отримують, поміщаючи каллусну тканину в колбу з рідким поживним середовищем. Суспензія перемішується в колбі на гойдалці, що має швидкість перемішування 100 – 120 об/хв. При першому перенесення на свіже середовище видаляють великі шматочки вихідного каллусу і великі агрегати, фільтруючи через 1 – 2 шари марлі, нейлонові сита, шприц з відповідним отвором. Для ініціалізації суспензійної культури необхідно 2 – 3 г свіжої маси каллусних культур на 60 – 100 мл рідкого поживного середовища. Однак для кожної лінії культури клітин існує мінімальний обсяг інокуляту, при меншому розмірі якого культура не росте.
Ріст суспензійних культур клітин можна оцінювати за одним або кількома такими параметрами:
1. Обсяг осаджених клітин (ООК). Переносять невеликий обсяг суспензійної культури в мірну пробірку об'ємом 15 мл, краще всього конічну. Центрифугують 5 хвилин при 200 g. ООК – величина, яку складає обсяг осаду від об'єму суспензії, зазвичай, у %.
2. Число клітин. Підраховується в камері Фукса-Розенталя.
3. Сира й суха маса. Суспензія клітин фільтрується через змочений і зважений фільтр, вкладений у воронку Бухнера під слабким вакуумом. Клітини промивають дистильованою водою, відтягують воду під вакуумом і зважують знову разом з фільтром. Суха маса – визначається аналогічно, але зважується сухий фільтр, а клітини сушать разом з фільтром в термостаті при 60ºС до постійної маси.
4. Вміст білка. Для визначення білка клітини збирають на фільтрі зі скловолокна, двічі промивають киплячим розчином 70% етанолу, сушать ацетоном, гідролізують 1М NaOH при температурі 85ºС півтори години. Потім фільтрують і визначають білок за методом Лоурі.
5. Провідність середовища. Визначають за допомогою кондуктометра. Як правило, вона обернено пропорційна свіжій масі клітин.
6. Життєздатність клітин. Оцінюють, вивчаючи рух цитоплазми під мікроскопом, а також за допомогою прижиттєвих барвників (флюоресцеіндіацетат, солі тетразолію, синій Еванса). Перед використанням підбирають рН інкубаційного буфера, концентрацію барвника, час інкубації, будують калібрувальні криві для суміші живих і вбитих клітин.
За отриманими даними будують ростові криві, які мають S-подібну форму і складаються з декількох ділянок: 1 – латентна, або лаг-фаза, де видимий ріст не спостерігається ні по одному з критеріїв, 2 – експонентна, ріст з прискоренням; 3 – лінійна , де швидкість росту постійна; 4 – фаза уповільненого зростання; 5 – стаціонарна фаза; 6 – фаза деградації клітин (рис. 1).
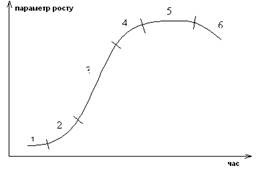
Рис. 1. Ростова крива.
Реальна ростова крива може дещо відрізнятися від модельної. На форму ростових кривих впливають і генетична характеристика популяції (вид рослини), і кількість інокуляту, і умови вирощування (склад середовища, початкове значення рН, складу газової фази, швидкість перемішування).
Необхідно відзначити, що ростові криві для різних критеріїв не ідентичні. Дисбаланс між швидкостями клітинного розмноження (число клітин), синтезу структурних елементів клітини (суха маса) і збільшення обсягу та змісту вакуоль (сира маса) відображає специфіку онтогенезу вищої рослини.
Для глибинного культивування рослинних клітин застосовуються способи, розроблені в мікробіології. Розрізняють два види систем культивування: відкриту і закриту.
Для закритої системи характерний періодичний режим вирощування. Клітинна маса (інокулят) поміщається в певний об'єм середовища. Система закрита за всіма параметрами, крім газів, до кінця вирощування. Періодично подається свіже поживне середовище, а старе видаляється в тому ж обсязі. Клітини залишаються в системі протягом усього циклу вирощування.
Відкриті (проточні) культури характеризуються надходженням свіжого поживного середовища, при якому відбирається не тільки старе поживне середовище, але і частина врожаю клітинної маси.
Найбільш вивчено та розповсюджено закрите глибинне культивування. Для аерації і перемішування використовують різну апаратуру: ролери, гойдалки, магнітні мішалки і т.д. Дуже велике значення для росту і біосинтезу клітин in vitro мають технічні характеристики систем культивування. При масштабуванні від невеликих за обсягом культур у колбах до великих багатолітрових ферментерів змінюються більшість параметрів культивування, зокрема аерація і перемішуваність.
Для культивування суспензій у виробничих масштабах застосовується апаратура, розроблена для мікробіологічної промисловості, проте дослідження останніх років показали, що рослинні клітини в силу своїх специфічних особливостей вимагають особливих посудин для культивування. Клітини рослин в десятки, сотні разів більше клітин бактерій і грибів, крім того, їх розміри змінюються в процесі онтогенезу. Якщо на початку експоненційної фази росту вони дрібні і щільні, то в стаціонарній фазі росту вони сильно збільшуються в розмірах і вакуолізуються. Чим більшою стає клітина, тим більше зростає небезпека її механічного пошкодження в процесі перемішування. У той же час клітини рослин, великі і важкі, вимагають ефективного перемішування. Осідання їх приводить до появи «мертвих» зон в посудинах, в яких відбувається швидке накопичення і старіння клітин. Для культури клітин женьшеню негативний вплив механічного стресу при вирощуванні в ферментері з турбінними мішалками позначалося на життєздатності клітин вже при швидкостях мішалок понад 100 – 350 об/хв, це негативно впливало на синтез ними антрахінонів. Стійкість штаму до механічного стресу є важливою вимогою до культури і важким завданням для дослідників.
М'яке перемішування і аерацію забезпечує пневматичний спосіб перемішування потоком стисненого стерильного повітря, що подається в ферментер з висхідним потоком повітря. На жаль, і цей спосіб має свій недолік, тому що в культуральному середовищі виникає надлишок повітря, що призводить до кисневого голодування. Від концентрації кисню в середовищі залежать ріст і вторинний метаболізм клітин. У мікробіологічних системах вивчена взаємозалежність росту біомаси, виходу шуканого продукту і постачання киснем. Для рослин таких даних немає.
На ріст клітин, крім кисню, можуть впливати і інші гази. Наприклад, вуглекислий газ може істотно впливати на довжину лаг-фази. Високий ступінь аерації може надавати негативну дію на ріст і синтез продуктів вторинного метаболізму, оскільки видаляються вуглекислий газ і леткі сполуки. Клітини рослин in vitro в порівнянні з мікроорганізмами мають низьку інтенсивність дихання, що теж повинно враховуватися при конструюванні посудини для культивування. Порівнювали ріст та освіта метаболітів клітинами в ферментерах різних типів. Клітини морінди лимонолистної, культивовані в ферментерах з продуванням повітря, містили антрахінону на 30% більше, ніж у колбах, і в два рази більше, ніж у ферментерах інших систем. Вихід біомаси клітин не змінювався залежно від типу біореактора. Клітини барвінку рожевого (Catharantus roseus) також синтезували більше індольних алкалоїдів при культивуванні в ферментері з продуванням повітря, ніж в біореакторах з механічним перемішуванням.
Відмінна особливість суспензійних культур клітин рослин – висока густина, необхідна для росту. Тому іншим ускладненням при культивуванні клітин рослин є збільшення в'язкості, яке супроводжує ріст біомаси. Це веде до адгезії. Адгезія (прилипання) клітин одна до одної, на поверхні культуральної судини і занурених у нього мішалок і датчиків викликає труднощі. У верхній частині судини поступово може утворюватися піна, що складається з білків і полісахаридів, які виділяються клітинами. У процесі культивування клітини злипаються і частина з них накопичується в цій піні, утворюючи «кірку». Зі збільшенням біомаси клітин збільшується і ця «шкірка», знижуючи інтенсивність перемішування, що врешті-решт може призвести культуру до загибелі.
Клітини рослин мають меншу фізіологічну та метаболічну активність у порівнянні з мікроорганізмами. Час генерації (інтервал часу між двома послідовними клітинними поділами) рослинної клітини в 60 – 100 разів перевершує час генерації мікробної клітини. Пул проліферуючих клітин не перевищує 50 – 60%, багато клітини швидко припиняють ділення і переходять у фазу спокою.
Всі ці обставини визначають тривале зростання популяції клітин при накопичувальному, або періодичному, вирощуванні. Підтримання стерильності тривалий час також є однією з технічних проблем, особливо при безперервному культивуванні.
Періодичне, або накопичувальне, культивування – це найпростіший спосіб вирощування клітин, що є поки традиційним. Суспензійні культури використовують для промислового отримання вторинних метаболітів. Речовини, які продукують рослинними клітинами використовуються в медицині, парфумерній промисловості, рослинництві та інших галузях промисловості. До них відносяться: алкалоїди, терпеноїди, глікозиди, поліфеноли, полісахариди, ефірні масла, пігменти, антиканцерогени (птотецін, харрингтонін), пептиди (інгібітори фітовірусів). В даний час в різних країнах близько ста видів рослин використовується в біосинтетичній промисловості для одержання економічно важливих речовин, серед них – женьшень, раувольфія зміїна, наперстянка шерстиста і пурпурна, діоскорея дельтовидна, беладонна, паслін часточковий, дурман звичайний, конвалія травнева, рицина, агава, мак снотворний та ін.
Отримання вторинних метаболітів має свої особливості. Ділення клітин, що приводить до збільшення клітинної біомаси, і синтез вторинних метаболітів роз'єднані в часі. Накопичення вторинних метаболітів зростає у фазі уповільненого росту клітинної популяції і досягає максимуму в стаціонарній фазі. Деякі алкалоїди активно синтезуються у фазі максимальної мітотичної активності (експонентний ріст), що є винятком. Знання таких закономірностей дозволяє регулювати процеси одержання цінних речовин. Механізми і умови, що блокують активний ріст клітин і клітинну проліферацію, одночасно активують ферменти вторинного метаболізму. Неспецифічні стресові умови, які впливають на клітини в кінці експоненційної фази, можуть стимулювати перехід до синтезу вторинних метаболітів і збільшувати їх вихід. Необхідно враховувати, що питання взаємодії первинного і вторинного метаболізму, розглянутий нами у спрощеному вигляді, набагато складніше.
Дата добавления: 2015-07-14; просмотров: 1226;
