БУДОВА ТА ФУНКЦІЇ КЛІТИНИ
Залежно від наявності справжнього сформованого ядра, всі клітинні організми поділяються на дві групи: прокаріоти і еукаріоти.
Прокаріоти (без’ядерні організми) — примітивні організми, що не мають чітко сформованого ядра. У таких клітинах виділяється лише ядерна зона, що містить молекулу ДНК. Крім цього, у клітинах прокаріотів немає багато органел. У них є тільки зовнішня клітинна мембрана і рибосоми. До прокаріот відносяться бактерії та синьо-зелені водорості (ціанеї).
Еукаріоти — справжні ядерні організми, клітини яких мають чітко сформоване ядро і всі основні структурні компоненти клітини. До еукаріот відносяться рослини, тварини, гриби. Еукаріотична клітина має складну будову. Вона складається з трьох основних взаємозв’язаних частин: 1) зовнішньої клітинної мембрани, у деяких додатково є оболонка; 2) цитоплазми та її органел; 3) ядра.
Зовнішня клітинна мембрана — двомембранна клітинна структура, що відмежовує внутрішній вміст клітин від зовнішнього середовища. Клітинна мембрана має вибіркову проникність, захищає клітину, регулює надходження речовин і обмін із зовнішнім середовищем, підтримує визначену її форму. Клітинна мембрана складається з подвійного шару фосфоліпідів, які своїми гідрофобними кінцями з радикалів вищих жирних кислот обернені один до одного; ззовні розташовуються гідрофільні залишки фосфорної кислоти та гліцерину. У біліпідний шар мембрани вкраплені молекули білків, одна частина яких пронизує наскрізь мембрану, а інша — розташовується на поверхні або частково занурена в неї. З її зовнішнього боку з білками і ліпідами з’єднані вуглеводи.
Речовини надходять до клітин різними шляхами: дифузно (низькомолекулярні іони); осмосом (вода); активним транспортом (через спеціальні білкові канали) із затратою енергії; за допомогою ендоцитозу (великі частинки).
Клітини рослинних організмів, грибів крім мембрани зовні мають ще й оболонку. Ця нежива клітинна структура будується з целюлози, що додає міцності клітині, захищає її, є «скелетом» рослин і грибів. В оболонці розміщені пори, через які речовини надходять до клітини.
У цитоплазмі, для якої характерний напіврідкий стан, знаходяться всі органели.
Ендоплазматична сітка (ЕПС) — одномембранна система канальців, трубочок, цистерн, що пронизує всю цитоплазму. Вона поділяє її на окремі відсіки, у яких проходить синтез різних речовин, забезпечує зв’язок між окремими частинами клітини і транспорт речовин. Розрізняють гладеньку і гранулярну ЕПС.
На гладенькій — проходить синтез ліпідів, вуглеводів; на гранулярній — розташовуються рибосоми і синтезується білок.
Рибосоми — дрібні тільця, які мають форму гриба. Складаються з двох субодиниць — великої та малої, будуються з р-РНК та білків. Функція рибосом — синтез білка.
Апарат Гольджі — одномембранна структура, пов’язана з ЕПС, забезпечує упакування і виведення синтезованих речовин із клітини. Крім цього, з його структур утворюються лізосоми.
Лізосоми — сферичні тільця, що містять гідролітичні ферменти, які розщеплюють високомолекулярні речовини, тобто забезпечують внутрішньоклітинне травлення.
Мітохондрїі — напівавтономні двомембранні структури подовгастої форми. Зовнішня мембрана гладенька, а внутрішня утворює складки-кристи, що збільшують її поверхню. Всередині мітохондрії заповнені матриксом, у якому знаходяться кільцева молекула ДНК, РНК, рибосоми.
Кількість мітохондрій у клітинах різна, з ростом клітин чисельність їх збільшується внаслідок поділу. Мітохондрії — це «енергетичні станції» клітини. У процесі дихання в них відбувається остаточне окиснення речовин киснем повітря. Енергія, що виділяється, нагромаджується в молекулах АТФ, синтез яких проходить у цих структурах.
Пластиди характерні тільки для рослинних клітин. Існують три види пластид: хлоропласти, лейкопласти і хромопласти.
Хлоропласти — напівавтономні двомембранні органели подовгастої форми, зеленого кольору. Внутрішня частина заповнена стромою, у якій занурені грани. Грани утворені з мембранних структур — тилакоїдів. У стромі є кільцева молекула ДНК, РНК, рибосоми. На мембранах розташовується фотосинтезуючий пігмент — хлорофіл. У хлоропластах відбувається процес фотосинтезу. На мембрані тилакоїда відбуваються реакції світлової фази фотосинтезу, а в стромі — темнової.
Хромопласти — двомембранні органели сферичної форми, що містять червоний, жовтогарячий і жовтий пігменти. Хромопласти надають забарвлення квіткам і плодам, а утворюються з хлоропластів.
Лейкопласти — безбарвні пластиди, які знаходяться в незабарвлених частинах рослини. Містять запасні поживні речовини, можуть на світлі перетворюватися у хлоропласти.
Крім хлоропластів рослинні клітини мають ще вакуолі — мембранні тільця, заповнені клітинним соком і поживними речовинами.
Клітинний центр забезпечує процес поділу клітин. Він складається з двох центріолей та центросфери, що утворюють нитки веретена поділу і сприяють рівномірному розподілу хромосом у клітині, яка ділиться. Характерні для тваринних клітин.
Ядро — центр регуляції життєдіяльності клітини. Ядро відокремлене від цитоплазми подвійною ядерною мембраною, пронизаною порами. Всередині воно заповнене каріоплазмою, у якій знаходяться молекули ДНК. Ядерний апарат регулює всі процеси життєдіяльності клітини, забезпечує передачу спадкової інформації. Тут відбувається синтез ДНК, РГІК, рибосом. Часто в ядрі можна побачити одне або декілька темних округлих утворень — ядерець, в яких формуються і нагромаджуються рибосоми. Молекули ДНК несуть спадкову інформацію, що визначає ознаки даного організму, органа, тканини, клітини. У ядрі молекул ДНК не видно, тому що вони знаходяться у вигляді тонких ниток хроматину. Під час поділу клітини ДНК сильно спіралізуються, товстішають, утворюють комплекси з білком і перетворюються в добре помітні структури — хромосоми.
Деякі клітини мають специфічні органели — війки та джгутики, які забезпечують рух, переважно, одноклітинних організмів. Ці структури є у деяких клітин багатоклітинних організмів (війчастий епітелій). Війки та джгутики являють собою вирости цитоплазми, оточені клітинною мембраною. В середині виростів знаходяться мікротрубочки, скорочення яких надає клітині руху.
Для вивчення морфології мікроорганізмів у прохідному світлі використовують оптичні мікроскопи МБР (рис. 1.1), МБД.
Механічна частина складається зі штатива з предметним столиком, тубуса, револьвера, механізму наведення різкості, що складається з макрометричного й мікрометричного гвинтів.
Оптична частина мікроскопа включає об'єктив і окуляр. Об'єктив є найважливішою частиною мікроскопа. Він складається із системи лінз, укладених у металеву оправу. Одне з позначень на оправі відповідає значенню збільшення об'єктива. В мікроскопі МБР використовуються об'єктиви, що дають збільшення в 8, 40 і 90 разів. Це багатолінзові короткофокусні системи, від якості яких залежить, в основному, зображення об’єкту. Збільшення об'єктива залежить від фокусної відстані головної – фронтальної лінзи. Чим більше кривизна фронтальної лінзи, тим коротше фокусна відстань, тобто тим нижче треба опускати об'єктив над площиною препарату. Інші лінзи називаються корекційними, вони необхідні для усунення сферичної й хроматичної аберації.
Об’єктив дає дійсне, збільшене, зворотне зображення предмету.
Окуляр містить дві лінзи – очну (верхню) і польову або збірну (нижню). Польові лінзи збирають промені, які йдуть від об’єктиву. Очна лінза збільшує зображення, яке дає об’єктив. Окуляри можуть давати збільшення в 5, 7, 10, 12, 15 і 20 разів, що зазначено на їхній оправі.
Окуляр дає збільшене, уявне, пряме зображення по відношенню до зображення, яке дає об’єктив. Окуляри можуть бути різних типів, їх вибір залежить від об’єктивів.
Освітлювальна система включає дзеркало з двома поверхнями (увігнутою та плоскою) і конденсора (у мікроскопі МБД є убудоване джерело світла). Увігнуте дзеркало збирає й концентрує в площині препарату пучок рівнобіжних променів світла, що йдуть від джерела світла, тому їм користаються в тих випадках, коли працюють без конденсора, тобто з малим збільшенням. Конденсор, укріплений безпосередньо над дзеркалом, складається з двох лінз і призначений для збирання паралельних променів світла, відбитих дзеркалом, у
1 – основа мікроскопа; 2 – предметний столик; 3 – гвинти для переміщення предметного столику; 4 – клеми для фіксації препарату; 5 – конденсор; 6 – кронштейн конденсора; 7 – гвинт, що закріплює конденсор у гільзі; 8 – гвинт переміщення конденсора; 9 – ручка ірисової діафрагми конденсора; 10 – дзеркало; 11 – тубусоутримувач; 12 – макрометричний гвинт (кремальєра); 13 – мікрометричний гвинт; 14 – револьвер; 15 – об’єктиви; 16 –тубус; 17 –гвинт для кріплення тубуса; 18 – окуляр.
крапці-фокусі, що знаходиться в площині препарату. Убудована в конденсор ірисова діафрагма служить для затримання зайвих променів світла і дозволяє при необхідності зменшувати апертуру конденсора.
Загальне збільшення, що дає мікроскоп, визначається добутком збільшення об'єктива на збільшення окуляра. Виразність одержуваного зображення характеризується дозвільною здатністю, що визначається мінімальною відстанню між двома крапками, коли вони ще не зливаються в одну.
Величина дозвільної здатності мікроскопа залежить від довжини хвилі використовуваного світла (l) і суми числових апертур об'єктива (A1) і конденсора (A2):
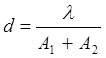 (1.1)
(1.1)
Числова апертура (A) визначається добутком синуса половини кута охоплення лінзи (U)та показника заломлення середовища (n), що граничить із лінзою: A = sin U·n. Тобто числова апертура характеризується кількістю променів, що попадають у лінзу (рис. 1.2).
Дозвільна здатність мікроскопа – величина, зворотна дозвільної відстані. Чим більше дозвільна здатність, тим меншої величини об'єкт можна побачити. Світловий мікроскоп за умов використання видимого світла має дозвільну здатність близько 0,2 мкм.
Підвищити дозвільну здатність можна двома шляхами: висвітлюючи об'єкт більш короткими променями світла, наприклад, УФ, або, збільшуючи показник середовища, що граничить із лінзою, для того, щоб наблизити його до показника заломлення скла (n скла = 1,5). У вивченні мікроорганізмів майже постійно користаються імерсійним, або олієзануреним об'єктивом (90х), що дає збільшення у 900–1350 разів (рис. 1.3).
Тому всі промені, не переломлюючись і не змінюючи свого напрямку, потрапляють в об'єктив і забезпечують гарну видимість дрібних об'єктів.
Мікроскопія в темному полі. Основи цього методу розроблено австрійським вченим Р. Зігмонді, він дає можливість підвищувати дозвільну здатність мікроскопу в 10 разів і використовується для дослідження об'єктів малої величини. Для цього в біологічному мікроскопі звичайний конденсор заміняють спеціальним конденсором темного поля, що має затемнену середню частину і пропускає тільки бічні промені.
Таким чином, мікроскопія в темному полі базується на висвітленні об'єкта косими променями світла (явище Тиндаля). Ці промені, не потрапляючи в об'єктив, залишаються невидимими для ока, тому поле зору виглядає зовсім чорним (рис. 1.4).
Якщо препарат містить якісь частки, наприклад, мікроорганізми, то косі промені, проходячи через такий препарат, у значній мірі відбиваються від поверхні цих часток і, ухиляючись від свого первісного напрямку, попадають в об'єктив. Тоді спостерігач бачить на чорному фоні інтенсивно світні об'єкти з різким бічним контрастом. При цьому апертура конденсора повинна бути трохи більше апертури об'єктива (об'єктив необхідно діафрагмувати, а конденсор імергувати). Метод темного поля використовується для спостереження живих клітин мікроорганізмів.
Фазово-контрастна мікроскопія. Метод запропоновано голландським фізиком Ф. Церніке для спостереження за живими об’єктами.
Більшість препаратів живих мікроорганізмів слабо контрастні, тобто клітини мало відрізняються за забарвленням і прозорістю від навколишнього середовища. Проте світлова хвиля набуває певних змін: проходячи через ділянки препарату, що мають більший, ніж у навколишнього середовища показник заломлення, вона виходить із деяким відставанням за фазою. Спеціальний фазово-контрастний пристрій дозволяє оптичним шляхом перетворювати розходження за фазою в зміни амплітуди, у результаті чого живі прозорі об'єкти стають контрастними, їх можна побачити оком.
Оптична система, яка використовується для одержання фазового контрасту, складається з фазової пластинки в одній з лінз об'єктива, що має форму кільця, і кільцевої діафрагми в спеціальному конденсорному пристрої. Для одержання фазового ефекту необхідне точне сполучення фазового кільця з проекцією кільцевої діафрагми (рис. 1.5).
Метод фазового контрасту застосовується для дослідження живих клітин мікроорганізмів різних систематичних груп, контрастність яких досягається оптичним шляхом без втручання в фізіологічні процеси об’єктів, що вивчаються.
Люмінесцентна (флуоресцентна) мікроскопія. Вперше феномен люмінесценції для мікроскопічних досліджень було використано австрійським ученим А. Келером.
Деякі біологічні об’єкти здатні при освітленні короткохвильовими променями (синьо-фіолетовими, ультрафіолетовими) поглинати їх і випромінювати промені з більш довшою хвилею, при цьому виникає світіння жовто-зеленим або оранжевим кольором. Таке явище називається власною, або первинною, люмінесценцією.
Об’єкти, яким не притаманна первинна люмінесценція, можна обробити спеціальними флуорохромами (акридином жовтим, акридином оранжевим, аураміном, примуліном, конго червоним, тетрацикліном, хініном) і також спостерігати люмінесценцію, але це вже буде наведена, або вторинна люмінесценція. Препарати, забарвлені флуорохромами, вивчають на середовищах, що не здатні до люмінесценції (воді, гліцерині, фізіологічному розчині).
Оптична схема люмінесцентного мікроскопу відрізняється від схеми звичайного вибором джерела світла, а саме, заміною низько вольтової лампи на ртутну і наявністю на шляху променів двох світлофільтрів (синій – перед конденсором пропускає синьо-фіолетові промені видимого спектру, жовтий світлофільтр в окулярі мікроскопу гасить синьо-фіолетові промені, які заважають виявленню люмінесценції). Люмінесцентна мікроскопія – поєднання кольорового зображення з контрастністю об’єктів, дає можливість спостерігати за морфологією живих та мертвих клітин мікроорганізмів, досліджувати клітинні мікроструктури та функціонально-морфологічні зміни в клітині.
Електронна мікроскопія. Перший прототип сучасного електронного мікроскопа було побудовано радянським вченим Е. Руске. В електронному мікроскопі замість світлових променів використовують пучок електронів, які мають хвильові властивості. Нині широко використовують два типи електронних мікроскопів: трансмісійний і растровий.
В трансмісійному електронному мікроскопі пучок електронів рухається прямолінійно в безповітряному просторі від джерела електронів (розжарена нитка вольфрамової гармати) крізь досліджуваний об’єкт у напрямі до флуоресцентного екрану і викликає його світіння.
При дослідженні морфологічних особливостей клітин мікроорганізмів, їх товщина не повинна перевищувати 0,8–0,9 мкм. Контрастність зображення досягається за рахунок напилювання на досліджуваний об’єкт важких металів (хрому, золота, паладію) або обробки фосфорно-вольфрамовою кислотою і уранілацетатом.
Растровий електронний мікроскоп дозволяє отримувати об’ємне, тривимірне зображення об’єкта. Для цього тонкий рухомий електронний промінь дуже швидко і послідовно оббігає поверхню клітини і передає отриману інформацію на електронно-променеву трубку, що вкрита люмінофором.
Препарати для цього типу електронних мікроскопів піддають спеціальній обробці, основна мета якої – зневоднення об’єкту без порушення поверхні структур. Потім препарат вкривають тонким шаром сплаву золота або платини, що робить поверхню зразка електропровідною і дозволяє уникнути накопичення електричного заряду, який може знизити дозвільну здатність мікроскопа.
Бактерії складають найбільш велику і дуже різноманітну групу (понад 1600 видів) мікроорганізмів. Бактерії – це в основному одноклітинні організми, що розмножуються простим поперечним поділом. Морфологічно бактерії розрізняють за формою, взаємним розташуванням клітин, наявністю чи відсутністю джгутиків і капсул, здатністю клітин до спороутворення і т.п.
За формою бактерії поділяються на кілька груп: сферичні, циліндричні, спіральні, незвичайної форми і нитчасті.
Кулясті (сферичні) бактерії – коки (Coccus). Напрямок площини поділу клітин і характер взаємного розташування клітин використовують як систематичну ознаку для виділення родів сферичних бактерій. Діаметр коків 0,5–1,2 мкм. Кулясті бактерії, як правило, не мають джгутиків, нерухомі і спор не утворюють.
Моно- чи мікрококи (рід Micrococcus). Їхні клітини поділяються в будь-якій площині і відразу після поділу відокремлюються, розташовуючись поодиноко.
Диплококи (рід Diplococcus) і стрептококи (рід Streptococcus) утворюються у поділі клітин в одній площині; у диплококів клітини розташовуються попарно.
Стрептококи (рід Streptococcus) поділяються також в одній площині, але клітини не відокремлюються одна від одної , а утворюють ланцюжка.
Тетракоки (рід Tetracoccus) виникають за умов поділу клітин у двох взаємно перпендикулярних площинах, клітини утворюють групи по 4 особини.
Сарцини (рід Sarcina) формуються у розподілі клітин у трьох взаємно перпендикулярних площинах, при цьому утворюються пакети з 8–12 клітин і більше.
Стафілококи (рід Staphylococcus) представляють скупчення клітин, що нагадують виноградні грона. Поділ клітин відбувається в будь-якій площині.
Крім правильної кулястої форми, клітини можуть мати овальну чи ланцетоподібну форму (пневмококи), чи бобоподібну форму кавового зерна (гонококи, менінгококи).
Паличкоподібні (циліндричні) бактерії – найбільш чисельна та різноманітна група бактерій. Паличкоподібні бактерії розрізняють по величині клітин, їхньому розташуванню, обрису кінців клітини, по наявності чи відсутності джгутиків. Довжина клітин паличкоподібних бактерій коливається від десятих часток мкм до 10–15 мкм і більш, діаметр клітин від 0,5 до 1,0 мкм.
Більшість паличкоподібних мікроорганізмів – форми безспорові, вони називаються бактеріями (Bacterium, позначають Bact., чи B). Паличкоподібні бактерії, які здатні за несприятливих умов формувати спори, прийнято називати бацилами (Bacillus, позначають Bac.). Бактерії й бацили розташовуються поодиноко, чи попарно з'єднуються в ланцюжки, в останньому випадку їх називають відповідно стрептобактерії та стрептобацили. Спори різних бактерій відрізняються за формою, розмірам і положенню в клітині. За умов бацилярного положення спори локалізуються в клітині у центрі, ексцентрально чи термінально і при цьому клітина не змінює свою форму. Під час клостридіального формування спори клітина змінює форму, здобуваючи вид човника чи веретена. Ендоспора розташовується в стовщеній частині клітини центрально чи ексцентрально. Плектридіальне положення – це термінальна локалізація спори. У місці її розташування клітина розширюється й здобуває вид барабанної палички чи ракетки.
Звиті (спіральні) бактерії у залежності від форми й кількості витків поділяють на три типи клітин.
Вібріони (рід Vibrio) представлені короткими вигнутими паличками у формі коми. Клітини вібріонів вигнуті на 1/3–1/4 обороти. Довжина клітин складає 1–3 мкм.
Спірили (рід Spirillum) – клітини, що вигнуті на 2–3 обороту, мають форму латинської букви S. Розміри клітин у порівнянні з вібріонами значно крупніше – 15–20 мкм.
Спірохети (рід Spirochaeta) представлені дуже тонкими довгими клітинами штопороподібної форми з великим числом дрібних витків. Довжина клітин перевищує ширину в 5–200 разів. Число витків спіралі є одним із систематичних ознак для визначення виду.
Міксобактерії (слизисті бактерії). Група бактерій, які стоять на більш високому ступені розвитку, ніж описані вище. У деяких представників міксобактерій (Sorangsum, Poliangium) в світлопольному мікроскопі чітко видно диференційоване ядро. Вегетативні клітини мають паличкоподібну форму з загостреними або округлими кінцями. По мірі старіння вони скорочуються і переходять в мікроспори, які з’єднуються слизом й утворюють первинні або вторинні цисти, з яких в подальшому формуються плодові тіла.
Для спостереження за формою міксобактерій беруть колонії, які розвиваються навколо грудочок ґрунту на гелевих пластинах з клітковиною.
Нитчасті форми бактерій являють собою ланцюжки циліндричних клітин, часто оточені загальним чохлом. Розповсюджені в ґрунті, водоймах, особливо з високим вмістом заліза. Типовим представником нитчастих бактерій є Leptothrix, який відноситься до залізобактерій. Він окислює закисні форми заліза в окисні.
Актиноміцети – променисті грибки, займають проміжне положення між бактеріями й грибами. Вони одноклітинні прокаріотичні клітини, як бактерії, й утворюють гіллястий міцелій з довгими та розгалуженими нитками (гіфами), як у цвілевих грибів.
Актиноміцети відіграють велику роль в процесах ґрунтоутворення і оздоровлення ґрунтів. Вони трансформують і розкладають складні органічні сполуки (клітковину, гумус, хітин, лігнін та ін.). Актиноміцети утворюють специфічні продукти життєдіяльності, а саме антибіотики, ферменти, вітаміни, стимулятори росту.
На поживних середовищах актиноміцети утворюють пухнасті, бархатисті, мучнисті, переважно щільні колонії, які зростаються з субстратом, іноді з характерним запахом ґрунту. Міцелій актиноміцетів диференційований – одна частина занурена в субстрат (субстратний міцелій), інша знаходиться над субстратом (повітряний міцелій). Багато представників актиноміцетів в процесі життєдіяльності продукують пігменти, тому їх повітряний міцелій і особливо колонії забарвлені в сині, голубі, фіолетові, рожеві, бурі, коричневі або чорні кольори. На поверхні колоній виростає повітряний міцелій, на кінцях якого спороносці зі спорами, які служать для нестатевого розмноження. Актиноміцети розмножуються також вегетативно за допомогою шматочків міцелію. Актиноміцети відносяться до аеробів, гетеротрофів, мезофілів, за Грамом – грампозитивні.
Нокардії (проактиноміцети). Це перехідна форма мікроорганізмів, які займають проміжне місце між актиноміцетами та мікобактеріями. Повітряний міцелій у них відсутній або слабо розвинений. На поживних середовищах розвиваються колонії тістоподібної (м’якої) консистенції з характерним міцеліальним краєм. Забарвлення їх також різноманітне, як і в актиноміцетів. У молодому віці нокардії утворюють міцелій, який потім починає септуватися (в нитках утворюються перетинки) і розпадатися на паличкоподібні фрагменти, які в подальшому перетворюються на короткі палички, але частіше в коки. Типовим представником є культура Nocardia rubra, яка на поживних середовищах утворює колонії червоного кольору.
Мікобактерії. Це найбільш низько організовані актиноміцети. Справжнього міцелію не утворюють. Колонії тістоподібної консистенції, продукують пігмент. В молодому віці формують палички викривленої форми з нерівним контуром (зіркоподібні, іноді досить довгі, з боковими відростками). В старих культурах розгалужені палички розпадаються спочатку на більш короткі палички, потім на коки. Гетеротрофи, аероби, грампозитивні.
Бактерії незвичайної форми морфологічно різноманітні – тороїдальні (замкнені та незамкнені кільця), зіркоподібні, тубероідальні (паличкоподібні бактерії зі сферичним роздуттям), червоподібні із загостреними кінцями, стеблові, плоскі у вигляді квадратних пластинок або інших геометричних форм.
Багато представників бактерій – рухливі організми. За характером розташування й числом джгутиків розрізняють монотрихи – бактерії з одним джгутиком на одному з кінців клітини; лофотрихи – бактерії з декількома джгутиками, розташованими на одному з кінців клітини, амфітрихи – бактерії з полярним джгутикуванням на двох кінцях; перитрихи – бактерії з великим числом джгутиків по всій поверхні бактеріальної клітини.
Порядок виконання роботи
1. Для вивчення морфології бактерій заздалегідь приготувати настої різних природних субстратів: м'яса, риби, білка яйця, сіна, борошна, овочів, фруктів та ін. Невелику кількість матеріалу подрібнюють, поміщають у склянку, на кінчику скальпеля додають трохи крейди і заливають водопровідною водою на 2/3 об’єму склянки. Склянку з настоєм витримують у термостаті при температурі 25–28°С (чи в теплому приміщенні в темряві 3–5 днів). За цей час у середовищі накопичується маса різноманітних мікроорганізмів.
2. Приготувати та дослідити препарати живих клітин мікроорганізмів із природних субстратів:
- за методом «роздавленої краплі» – із кисломолочних продуктів;
- за методом «висячої краплі» – із гнилого м'яса, риби, настою біогумусу.
В обох випадках можливе забарвлення об'єкта «прижиттєвими» барвниками – вітальне фарбування. Як прижиттєві барвники можна використовувати метиленовий синій, нейтральний червоний у концентраціях від 0,001 до 0,0001 %.
- «препарат-відбиток» одного з представників актиноміцетів.
Оскільки міцелій актиноміцетів дуже тонкий і довгий, то для вивчення природного розташування клітин цих організмів варто приготувати препарати-відбитки. Покривне скло покласти на поверхню колонії, злегка притиснути до одержання чіткого відбитка, зняти за допомогою пінцета і помістити на предметне скло в краплю води відбитком униз. Паралельно приготовлений таким способом відбиток за аналогією з мазком бактерій висушують, фіксують жаром, забарвлюють і виконують мікроскопію, використовуючи об'єктив 90х з імерсією. Відбиток із такого ж способу можна одержати і на предметному склі.
3. Паралельно з рідини настоїв приготувати фіксовані та забарвлені (простим способом) препарати мікроорганізмів. Зробити мікроскопію спочатку із сухим об'єктивом 40х, потім переглянути, використовуючи імерсійну систему (об'єктив 90х).
4. Для вивчення морфології бактерій приготувати препарати з використанням колекції чистих культур різних морфологічних груп. Препарати розглянути з імерсією, відзначити форму й сполучення клітин різних мікроорганізмів.
5. Приготувати фіксований препарат-мазок із зубного нальоту. На предметне скло нанести бактеріологічною петлею краплю стерильного фізіологічного розчину чи водопровідної води, потім обережно знімають зубний наліт сірником, розтирають у краплі води та тонким шаром розподіляють на поверхні чистого знежиреного скла. Мазок підсушують у повітрі, фіксують і зафарблюють, розглядають з імерсією.
6. Приготувати прижиттєві препарати з негативним контрастуванням за допомогою рідкої туші з матеріалу будь-якого настою.
Рідкий препарат. На добре знежирене предметне скло мікробіологічною петлею наносять велику краплю досліджуваної культури мікроорганізмів. Суміш ретельно перемішують і накривають покривним склом. Покривне скло обережно притискають до предметного смужкою фільтрувального паперу. Виконують мікроскопію препарату, користаючись об'єктивом 40х. На темному фоні туші виявляються прозорі зони капсул навколо різко обкреслених клітин.
Висушений препарат. Краплю туші поміщають на добре знежирене предметне скло і змішують із краплею рідини, що містить бактерії. За допомогою покривного скла розподіляють мазок тонким шаром на поверхні предметного скла. Після того, як препарат висохне у повітрі, виконують його мікроскопію, користуючись об'єктивом МІ-90. У полі зору мікроскопа на загальному темному фоні туші чітко видно незабарвлені клітини мікроорганізмів різної форми, різних розмірів, розташовані в різноманітних сполученнях.
7. Усі переглянуті під мікроскопом препарати замалювати. Під кожним малюнком указати назву об'єкта, відзначити морфологічні особливості організмів і збільшення мікроскопа, з яким розглядався препарат.


| <== предыдущая лекция | | | следующая лекция ==> |
| Профилактика | | | Вимірник потужності дози /рентгенметр/ ДП-5В. |
Дата добавления: 2015-08-04; просмотров: 2593;
