Молекулярно-кінетична теорія. Основні положення МКТ
Молекулярно-кінетичною теорією називають вчення про будову й властивості речовини на основі уявлень про існування атомів і молекул як найменших частинок хімічної речовини.
В основі молекулярно-кінетичної теорії лежать три основних положення:
· Усі речовини – тверді, рідкі й газоподібні – утворені з дрібних частинок – молекул, які самі складаються з атомів;
· Молекули й атоми є електрично-нейтральними частинками. За певних умов молекули й атоми можуть набувати додатковий електричний заряд і перетворюватися в позитивні або негативні іони;
· Атоми й молекули перебувають у безупинному хаотичному русі.
Частинки взаємодіють між собою із силами, що мають електромагнетну природу. Гравітаційними взаємодіями між частинками в цьому випадку нехтують.
Найбільш яскравим експериментальним підтвердженням молекулярно-кінетичної теорії про безладний хаотичний рух атомів і молекул є броунівський рух. Це тепловий рух дрібних мікроскопічних частинок, завислих у рідині або газі. Броунівський рух був відкритий англійським ботаніком Броуном. Броунівські частинки рухаються під впливом безладних хаотичних ударів молекул. Через хаотичний тепловий рух молекул ці удари ніколи не врівноважуються. У результаті такого руху швидкість броунівської частинки безладно змінюється як за модулем так і за напрямком, а її траєкторія має складну зиґзаґоподібну будову (рис. 2.7).
Теорія броунівського руху була запропонована Ейнштейном і експериментально підтверджена в дослідженнях французького фізика Перрена.
Сили взаємодії молекул залежать від відстані між ними. Молекули є складними просторовими структурами, які містять як позитивні, так і негативні заряди. Якщо відстані між молекулами досить великі, то у їх взаємодіях переважають сили міжмолекулярного притягування. На малих відстанях переважаючими є сили відштовхування. Залежності результуючої сили F і потенціальної енергії Ep, взаємодії між молекулами, від відстані між їх центрами, якісно зображені на рис. 2.8.

Рис. 2.7
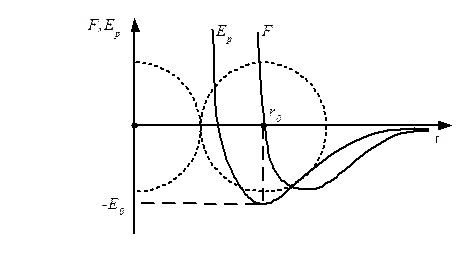
Рис. 2.8
На деякій відстані r = r0 сили взаємодії врівноважуються. Цю відстань умовно можна прийняти за діаметр молекули. Потенціальна енергія взаємодії при r = r0 мінімальна. Щоб віддалити дві молекули з відстані r0 за межі дії молекулярних сил, потрібно надати їм додаткову енергію E0. Величина енергії E0 називається глибиною потенціальної ями або енергією зв'язку.
Молекули мають надзвичайно малі розміри. Так діаметри одноатомних молекул не перевищують 10–10 м. Складні багатоатомні молекули можуть мати розміри у сотні й тисячі разів більші.
Безладний хаотичний рух молекул називається тепловим рухом. Кінетична енергія теплового руху зростає із зростанням температури. При низьких температурах середня кінетична енергія молекул може виявитися меншою глибини потенціальної ями E0. У цьому випадку молекули конденсуються у рідку або тверду речовину; при цьому середня відстань між ними наближається до r0.
При підвищенні температури середня кінетична енергія перевищить E0, і молекули, розлітаючись, утворять газоподібну речовину.
У твердих тілах молекули здійснюють безладні коливання біля фіксованих центрів (положень рівноваги). Ці центри можуть бути розташовані в просторі довільно (аморфні тіла), або утворювати упорядковані об'ємні структури (кристалічні тіла).
У рідинах молекули мають значну схильність до теплового руху. Вони не прив'язані до певних центрів і мають можливість переміщуватися по всьому об’єму рідини. Цим пояснюється текучість рідин. Молекули рідини, які розташовані поряд, можуть утворювати тимчасові упорядковані структури по кілька молекул у кожній. Це явище називається ближнім порядком, на відміну від далекого порядку, характерного для кристалічних тіл.
У газах відстані між молекулами значно більші за їх розміри. Сили міжмолекулярних взаємодій на таких відстанях дуже малі. Кожна молекула в цих умовах рухається уздовж прямої лінії до чергового зіткнення з іншою молекулою, або із стінкою посудини. Середня відстань вільного пробігу між молекулами повітря при нормальних умовах близька до 10–8 м, тобто в десятки разів перевищує розміри молекул. Слабка взаємодія між молекулами в газах є доказом здатності газів розширюватися й заповнювати весь об’єм посудини. У граничному випадку, коли взаємодії між молекулами наближаються до нуля, ми приходимо до поняття про ідеальний газ.
У молекулярно-кінетичній теорії кількість речовини прийнято вважати пропорційною числу частинок. Одиницею кількості речовини є моль.
Кількість речовини ν визначається відношенням числа N частинок (молекул) речовини до сталої Авогадро NA:
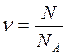 . (2.3.1)
. (2.3.1)
Масу одного моля речовини прийнято називати молярною масою 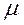 . Молярна маса дорівнює добутку маси m0 однієї молекули даної речовини помноженої на сталу Авогадро:
. Молярна маса дорівнює добутку маси m0 однієї молекули даної речовини помноженої на сталу Авогадро:
 = NA · m0. (2.3.2)
= NA · m0. (2.3.2)
Дата добавления: 2015-08-26; просмотров: 940;
