Внутрішня енергія. Кількість теплоти. Робота в термодинаміці
Термодинаміка – це наука про теплові явища. На противагу молекулярно-кінетичній теорії, яка ґрунтується на уявленнях про молекулярну будову речовини, термодинаміка виходить із найбільш загальних закономірностей теплових процесів і властивостей макроскопічних систем. Висновки термодинаміки спираються на сукупність дослідних фактів і не залежать від наших знань про внутрішню будову речовини, хоча в цілому ряді випадків термодинаміка використовує молекулярно-кінетичні моделі для ілюстрації своїх висновків.
Термодинаміка розглядає ізольованісистеми тіл, які перебувають у стані термодинамічної рівноваги. Це означає, що в таких системах зупинились всі макроскопічні процеси, які можна виявляти експериментально. Важливою властивістю термодинамічної рівноваги системи є вирівнювання температури всіх її частин.
Якщо термодинамічна система була піддана зовнішньому впливу, то в остаточному підсумку вона перейде в інший рівноважний стан. Такий перехід називається термодинамічним процесом. Якщо процес протікає повільно, то система, в кожен момент часу, буде все ближче наближатись до рівноважного стану. Процеси, які складаються із сукупності рівноважних станів, називаються квазістатичними.
Найважливішим поняттям термодинаміки є внутрішня енергія тіла. Усі макроскопічні тіла мають енергію, акумульовану всередині самих тіл. З точки зору молекулярно-кінетичної теорії внутрішня енергія речовини складається з кінетичної енергії всіх атомів і молекул і потенціальної енергії їх взаємодії. Зокрема, внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій усіх частинок газу, які перебувають у безупинному й безладному тепловому русі. Внутрішня енергія ідеального газу залежить тільки від його температури і не залежить від об’єму.
Молекулярно-кінетична теорія дає можливість одержати формулу для визначення внутрішньої енергії одного моля ідеального одноатомного газу (гелій, неон і ін.), молекули якого перебувають лише у поступальному русі:
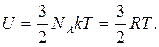 (2.4.1)
(2.4.1)
Оскільки потенціальна енергія взаємодії молекул залежить від відстані між ними, то у загальному випадку внутрішня енергія U тіла залежить поряд із температурою T також і від об’єму V:
U=U(VT). (2.4.2)
Таким чином, внутрішня енергія U тіла однозначно визначається макроскопічними параметрами, які характеризують стан тіла. Вона не залежить від того, яким шляхом був реалізований даний стан. Прийнято говорити, що внутрішня енергія є функцією стану.
Внутрішня енергія тіла може змінюватися, якщо зовнішні сили, що діють на тіло, виконують механічну роботу (позитивну або негативну). Наприклад, якщо газ стискають в циліндрі під поршнем, то зовнішні сили виконують над газом деяку позитивну роботу A'. У той же час сили тиску, що діють із боку газу на поршень, виконують роботу A = –A'. Якщо об’єм газу змінився на малу величину dV, то газ виконав роботу 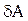
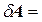 pSdx = pdV, (2.4.3)
pSdx = pdV, (2.4.3)
де p – тиск газу, S – площа поршня, dx – переміщення поршня (рис. 2.11).
При розширенні газу виконана робота позитивна, при стисненні – негативна. У загальному випадку при переході з деякого початкового стану (1) у кінцевий стан (2) робота газу визначається формулою:
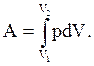
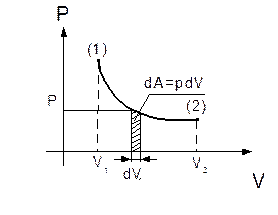
Рис. 2.11
Робота чисельно дорівнює площі під графіком процесу на (p, V) діаграмі. Величина роботи залежить від того, яким шляхом відбувався перехід із початкового стану в кінцевий стан. На рис. 2.12 зображені три різних процеси, що переводять газ із стану (1) у стан (2). В усіх трьох випадках газ виконує різну роботу.
Процеси, зображені на рис. 2.12, можна провести й у зворотному напрямку; тоді робота A змінить знак на протилежний. Процеси такого роду, які можна здійснювати в обох напрямках, називаються оборотними.
На відміну від газу, рідини й тверді тіла мало змінюють свій об’єм, так, що в багатьох випадках роботою, виконаною при розширенні або стисненні рідин або твердих тіл, можна знехтувати. Однак, внутрішня енергія рідких і твердих тіл, також може змінюватися в результаті виконання роботи. При механічній обробці деталей (наприклад, при свердлінні) вони нагріваються. Це означає, що змінюється їх внутрішня енергія.

Рис. 2.12
Внутрішня енергія тіла може змінюватися не лише в результаті виконаної роботи, але і внаслідок теплообміну. При тепловому контакті тіл внутрішня енергія одного з них може збільшуватися, а внутрішня енергія іншого – зменшуватися. В цьому випадку говорять про тепловий потік від одного тіла до іншого. Кількістю теплоти Q, отриманої тілом, називають зміну внутрішньої енергії тіла у результаті теплообміну.
Передача енергії від одного тіла іншому у формі тепла може відбуватися тільки при наявності різниці температур між ними.
Тепловий потік завжди спрямований від гарячого тіла до холодного.
Кількість теплоти Q є енергетичною величиною. Кількість теплоти у системі СІ, виміряється у одиницях механічної роботи – джоулях (Дж).
Дата добавления: 2015-08-26; просмотров: 1584;
